Skutki SSc‑ILD
Śródmiąższowa choroba płuc (ILD) jest ważną przyczyną zgonów u pacjentów z twardziną układową (SSc) i może mieć negatywny wpływ na jakość życia1-6

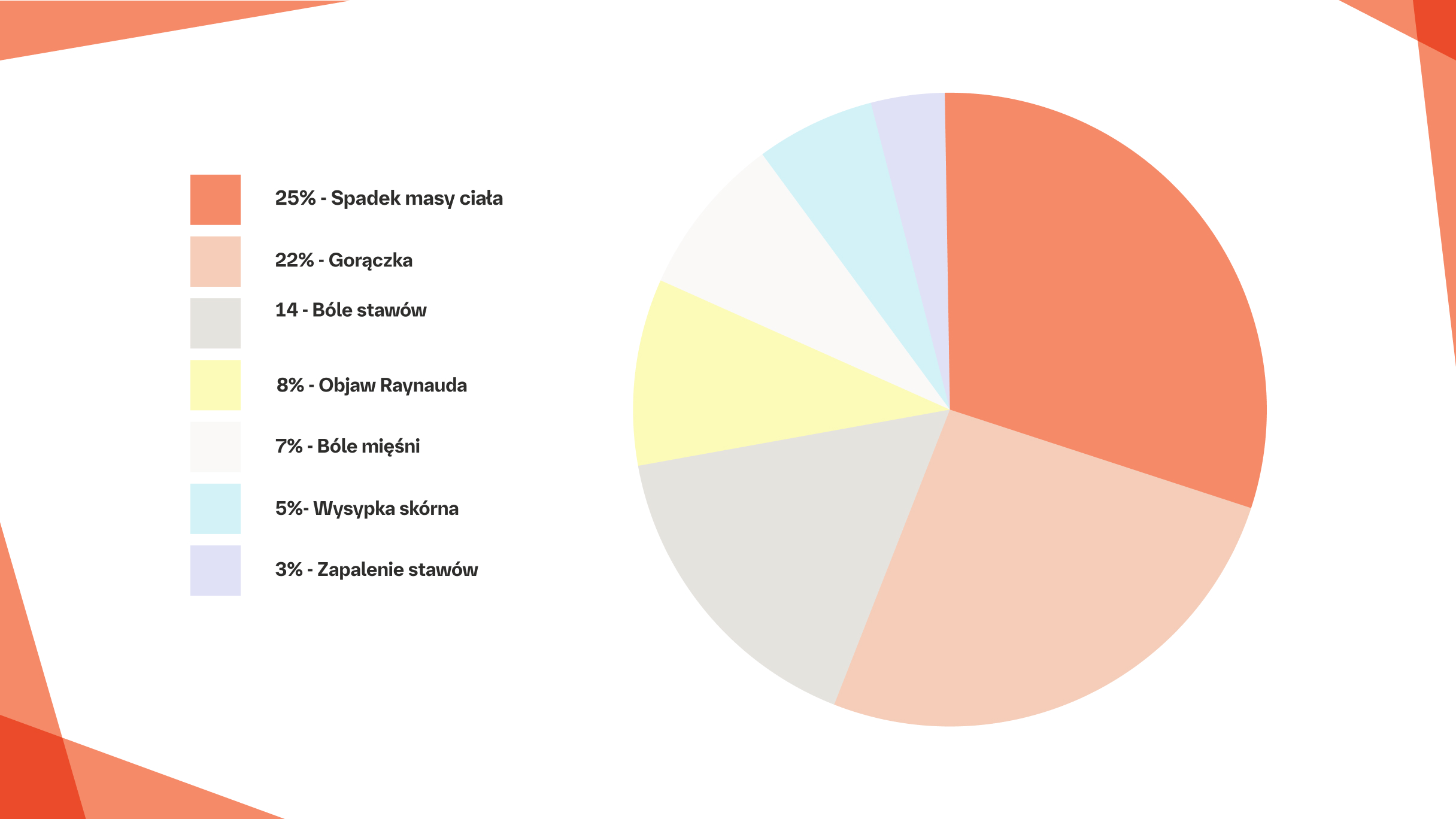
Przyczyny zgonów związanych z SSc (1997–2001).
Na podstawie: Steen VD and Mediger TA Ann Rheum Dis. 2007;66;944 and Tyndall AJ, et al. Ann Rheum Dis. 2010;69(10):1809-1815.
Wskaźniki przeżycia rocznego, 5- i 10-letniego u pacjentów z SSc-ILD w porównaniu z pacjentami z SSc bez ILD7
W kanadyjskiej kohorcie pacjentów z SSc-ILD wskaźniki przeżycia 5- i 10-letniego wynosiły odpowiednio 44,4% i 22%7
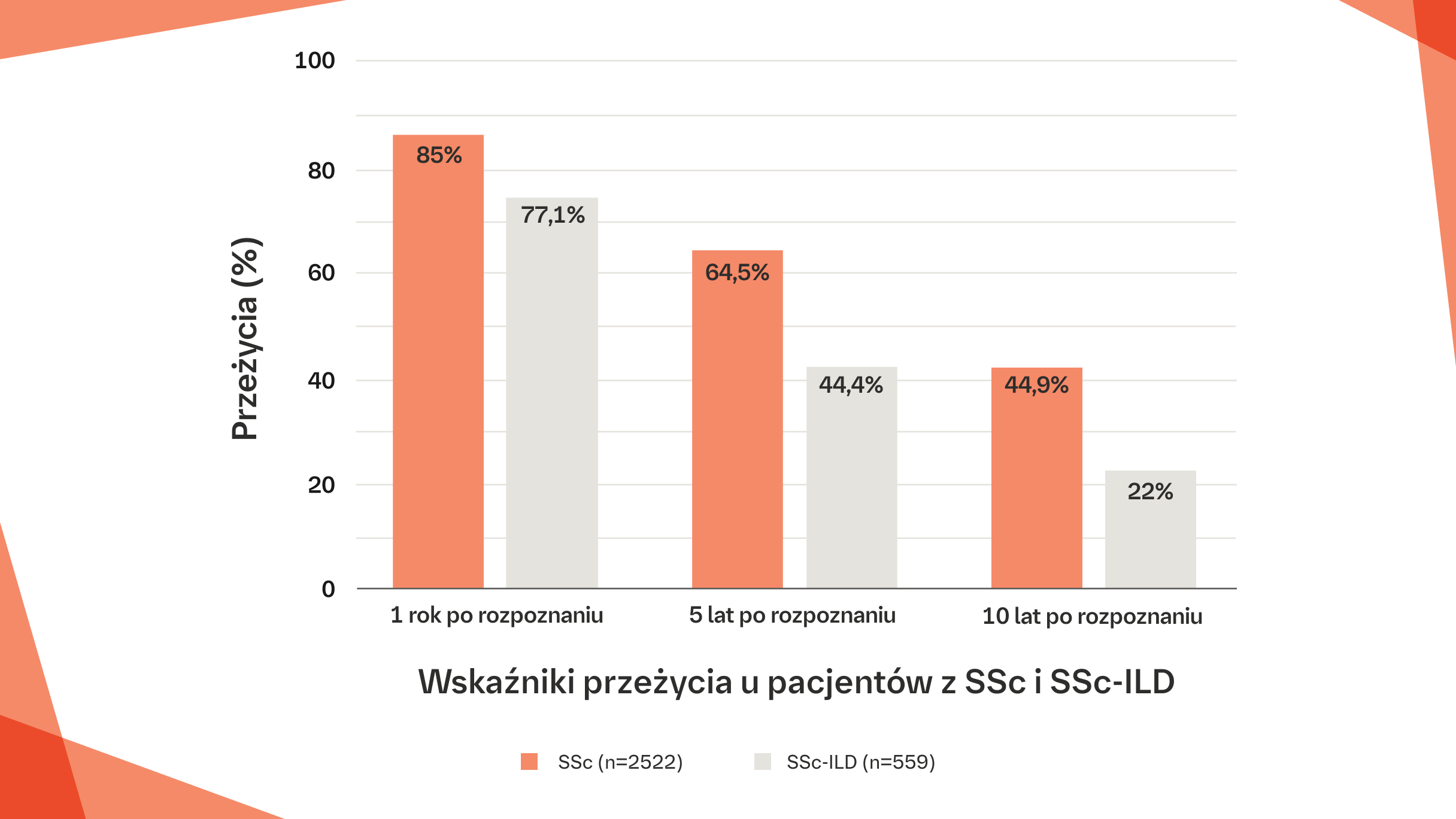
Na podstawie: Pope JE, et al. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
WŁÓKNIENIE PŁUC PODCZAS OCENY WYJŚCIOWEJ JEST ZWIĄZANE ZE ZWIĘKSZONĄ ŚMIERTELNOŚCIĄ W PORÓWNANIU Z NIEWYSTĘPOWANIEM WŁÓKNIENIA PŁUC U PACJENTÓW Z SSc‑ILD8
W norweskiej kohorcie SSc‑ILD włóknienie samo w sobie było związane z większym ryzykiem zgonu w SSc‑ILD8
Wykazano, że każdy stopień zwłóknienia płuc podczas oceny wyjściowej jest związany ze wzrostem ryzyko zgonu u pacjentów z SSc-ILD w porównaniu z populacją ogólną.8 Ten standardowy wskaźnik śmiertelności wzrasta wraz ze wzrostem stopnia zwłóknienia.8
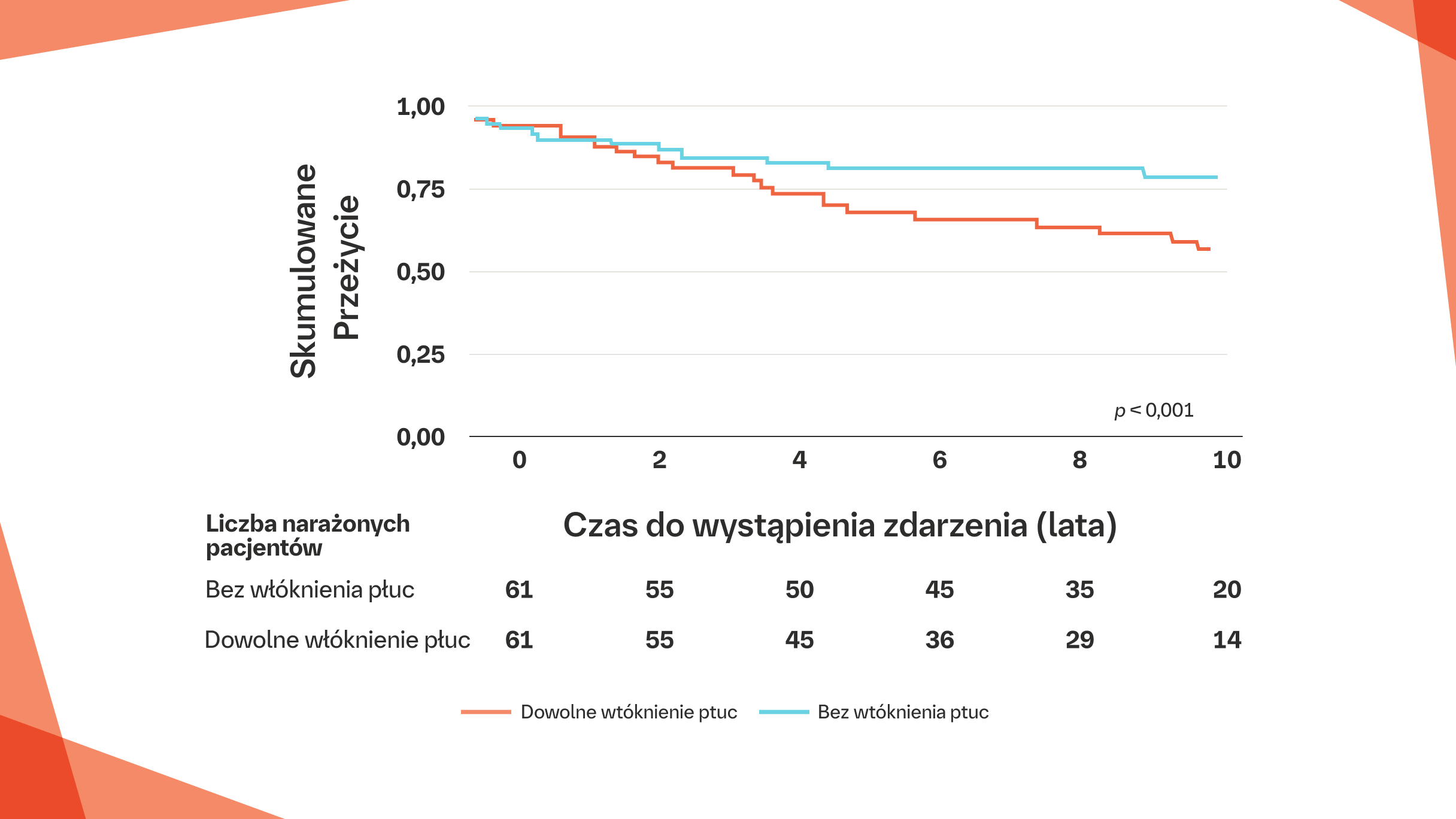
Skumulowane wskaźniki przeżycia 1,5 roku i 10 lat od rozpoznania ILD przedstawione za pomocą krzywych Kaplana-Meiera w kohorcie norweskiej. Czas do wystąpienia zgonu u pacjentów z FVC% w zakresie prawidłowym (FVC 80–100%) ze stratyfikacją według występowania lub niewystępowania włóknienia płuc w badaniu HRCT, p<0,001.
Na podstawie: Hoffmann-Void A-M, et al. Am J Respir Crit Care Med. 2019;200:1258-1286.
W norweskiej kohorcie pacjentów z SSc‑ILD, rozległość włóknienia oceniona na >10% w badaniu HRCT była związana z istotnie wyższymi standardowymi wskaźnikami śmiertelności8
Włóknienie płuc per se jest związane ze zwiększoną śmiertelnością w SSc, co wykazano po raz pierwszy w badaniu oceniającym kohortę norweską pacjentów z SSc (N=630).8 Wartość SMR była skorelowana ze stopniem zwłóknienia, przy czym najwyższe wartości SMR zaobserwowano u pacjentów z rozległością włóknienia ocenioną na >10% (wartość SMR zwiększała się od 2,2 u pacjentów bez włóknienia do 8,0 u pacjentów z włóknieniem obejmującym >25% płuc).8
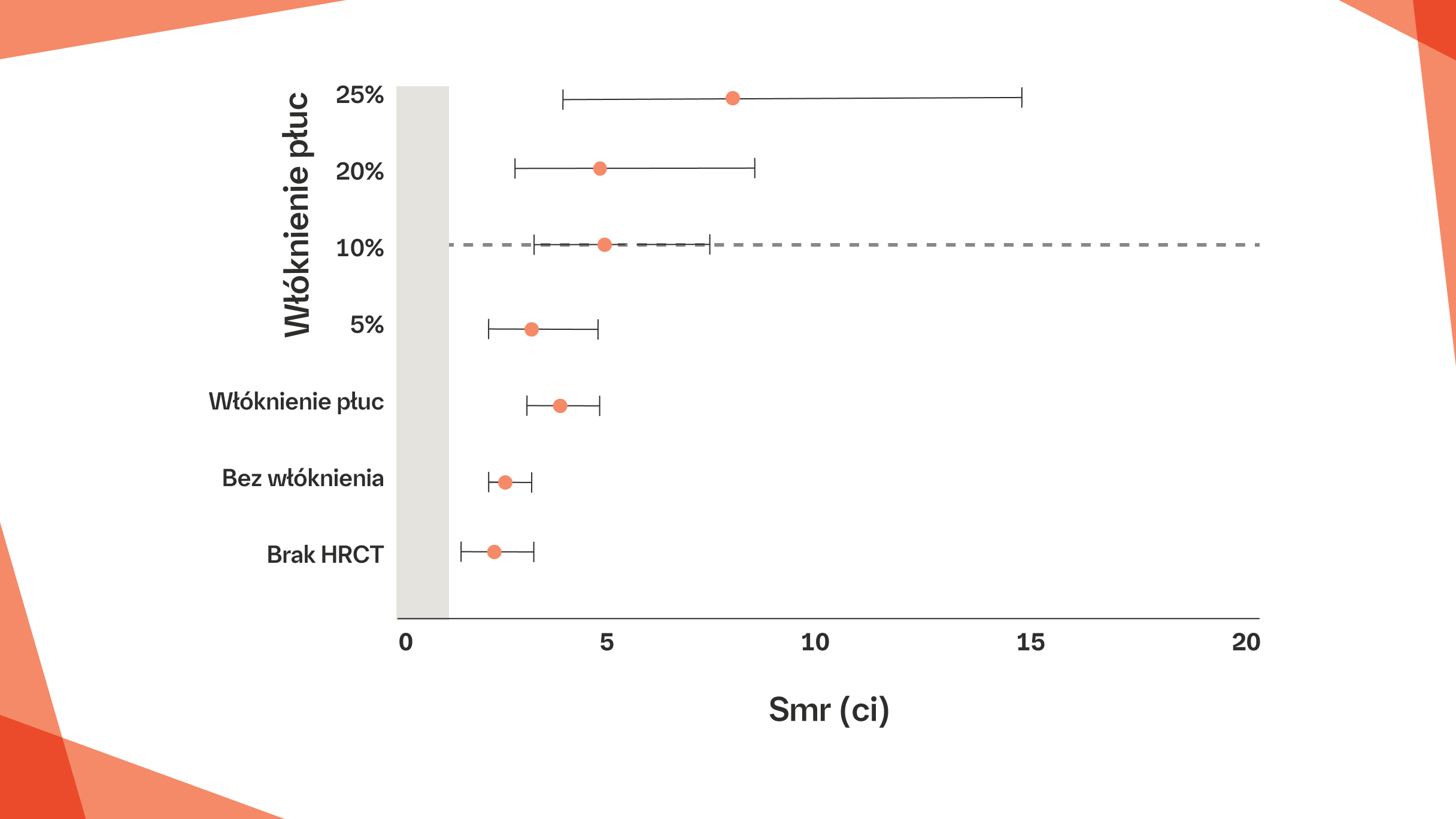
Na podstawie: Hoffmann-Vold A-M, et al. Am J Respir Crit Care Med. 2019;200:1258–1266.
Rozległa choroba płuc, sklasyfikowana jako rozległość choroby oceniona na >20% w badaniu HRCT, wiąże się z wyższą śmiertelnością (HR 2,48, 95% CI: 1,57–3,92, p<0,0005)9
Wartość progowa 20% dla rozległości choroby w badaniu HRCT jest związana z istotnym wzrostem śmiertelności9

Krzywa przeżycia Kaplana-Meiera pacjentów z SSc-ILD z rozległością choroby >20% w badaniu HRCT (n=64) oraz pacjentów z rozległością choroby ≤20% w badaniu HRCT (n=151).
Na podstawie: Goh NS, et al. AM J Respir Crit Care Med. 2008;177:1248-1254.
NAWET NIEWIELKI ROCZNY SPADEK FVC O <5% WARTOŚCI NALEŻNEJ MOŻE PROWADZIĆ DO ZGONU W CIĄGU 4–8 LAT U PACJENTÓW Z SSc‑ILD12
Niektóre badania sugerują, że spadek FVC następuje najszybciej we wczesnym okresie przebiegu SSc-ILD i może się ustabilizować po pierwszych 4 latach.12 Jednak najnowsze dane wskazują, że spadek FVC w SSc-ILD nie osiąga plateau po początkowym okresie progresji, ale postępuje w różnym tempie w sposób skorelowany z różnymi przedziałami czasowymi śmiertelności.12
Progresja % wartości należnej FVC u pacjentów z SSc‑ILD sklasyfikowanych według grup prognostycznych12
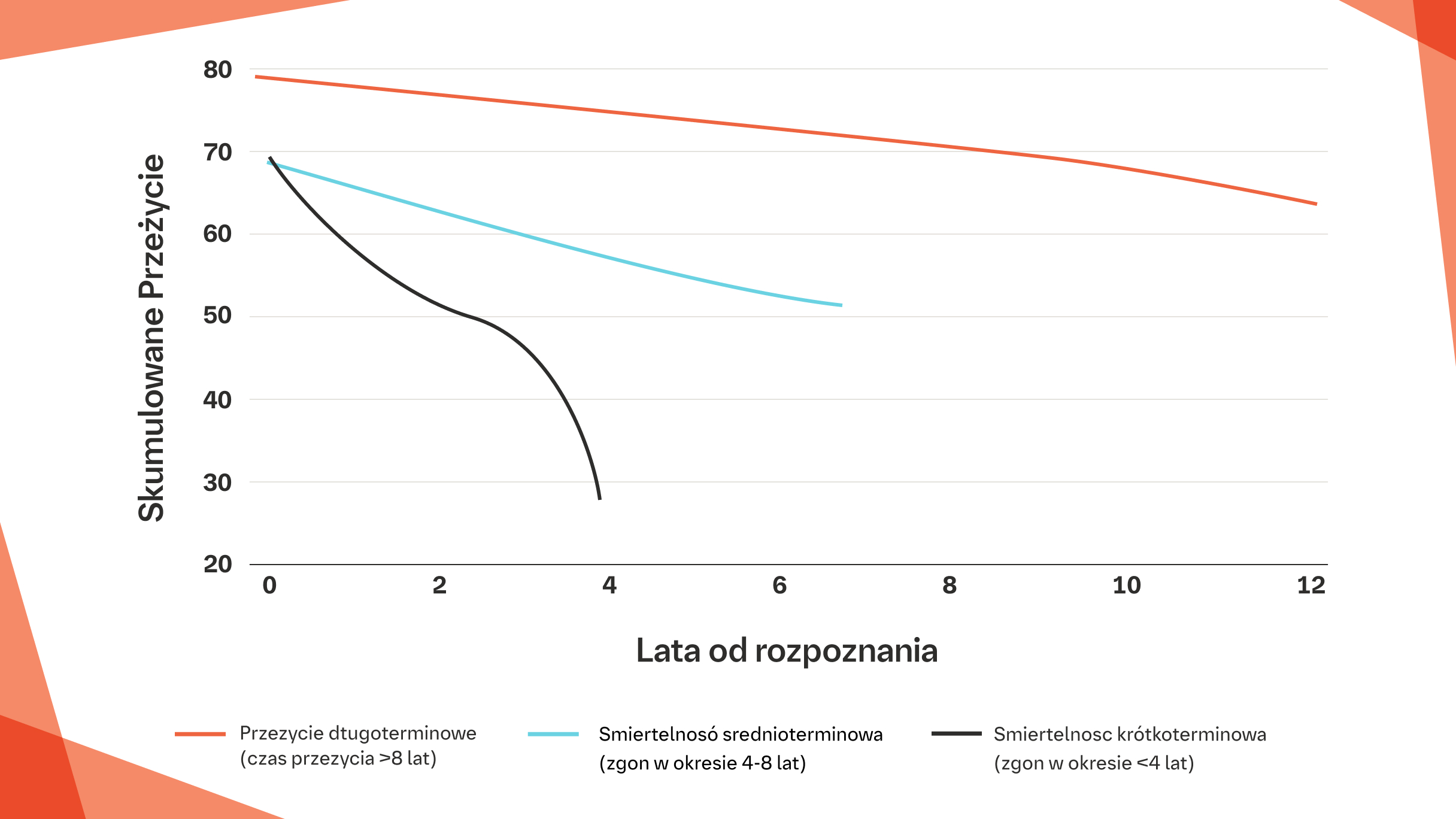
Progresja FVC (% wartości należnej) u 171 pacjentów z SSc-ILD sklasyfikowanych według grup prognostycznych.
Na podstawie: GulerSA, et al. Ann Am Thorac Soc. 2018:15,1427-1433.
Niska wartość FVC (% wartości należnej) i spadek wartości FVC są czynnikami predykcyjnymi zgonu w SSc‑ILD14
W długoterminowym badaniu brytyjskim roczny względny spadek FVC o ≥10% wartości należnej w ciągu 12 miesięcy był wyraźnie związany ze śmiertelnością u pacjentów z SSc-ILD w okresie 15 lat (HR 1,84, 95% CI: 1,14–2,97, p=0,01)14
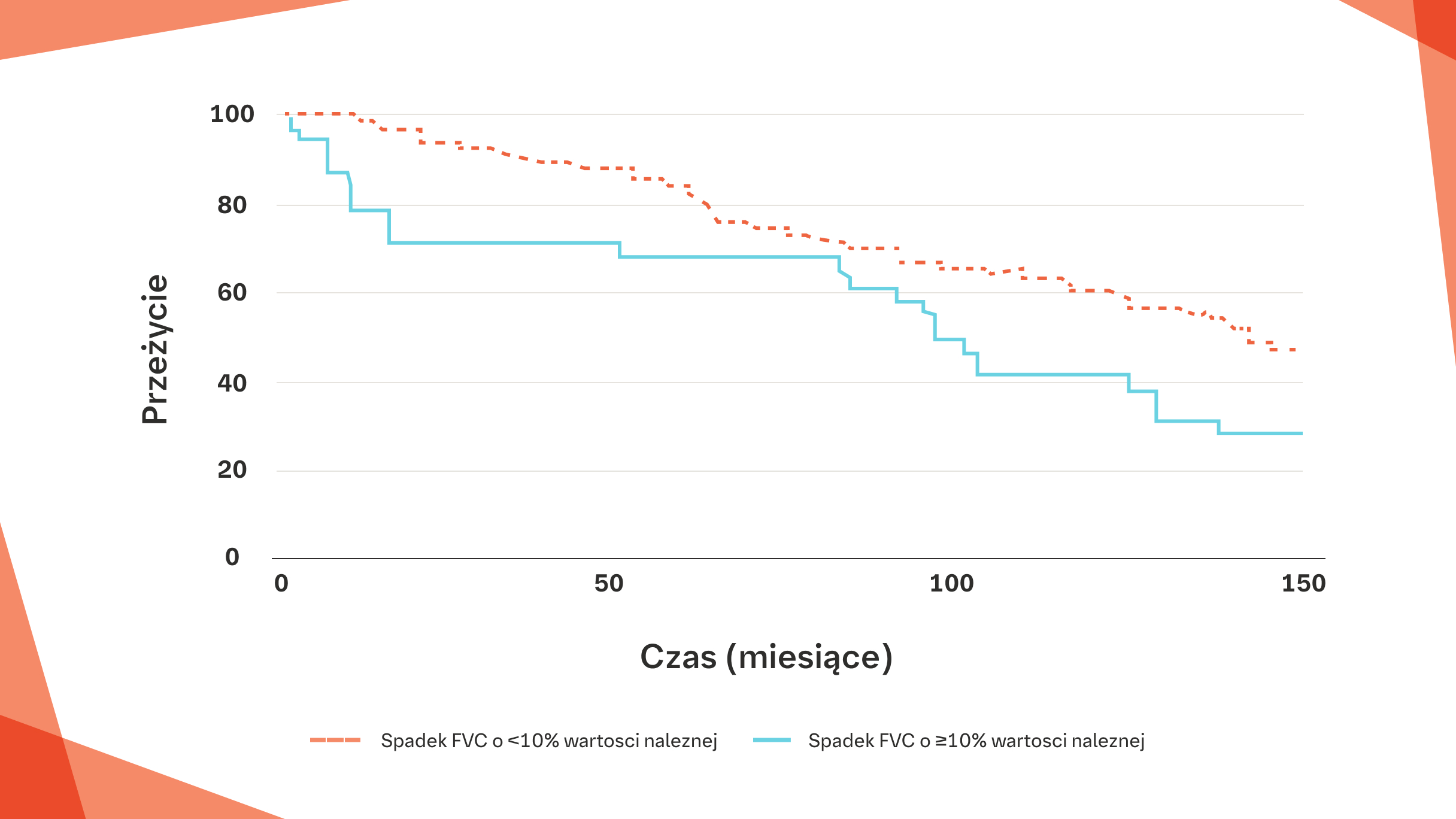
Krzywa przeżycia Kaplana-Meiera dla kohorty 162 pacjentów z SSc-ILD w grupach spadku FVC o <10% i spadku FVC o ≥10%.
Na podstawie: Golf NS, et al. Arthritis Rheumatol. 2017;69;1670-1678.
Wartość FVC <80% wartości należnej podczas oceny wyjściowej jest czynnikiem predykcyjnym zgonu u pacjentów z SSc‑ILD1

Wykresy przeżycia Kaplana-Meiera w SSc na podstawie danych z obserwacji 2940 pacjentów, z których 294 zmarło. Śmiertelność w SSc przedstawiono w zależności od występowania lub niewystępowania restrykcji płucnej.
Na podstawie: Tyndall AJ. et al. Ann Rheum Dis. 2010;69(10);1809-1815
STARSZY WIEK W CHWILI ROZPOZNANIA, PŁEĆ MĘSKA, ROZLEGŁOŚĆ WŁÓKNIENIA PŁUC, NISKIE WARTOŚCI WYJŚCIOWE ORAZ SPADEK FVC I DLCO SĄ CZYNNIKAMI RYZYKA ZGONU W SSc‑ILD1,8,14-16
Czynniki ryzyka zgonu w SSc‑ILD | |
| Wiek | Starszy wiek w chwili rozpoznania15,17 |
| Płeć | Męska15,17 |
| FVC | <80%1 |
| DLCO | Wyjściowy % wartości należnej DLCO <40%18 % wartości należnej DLCO <40%1 Spadek % wartości należnej DLCO o <15%19 |
| Rozległość włóknienia w HRCT | Rozległość choroby >10% w HRCT8 |
| Palenie tytoniu | Aktywne palenie tytoniu i palenie w wywiadzie12,15 |


OBJAWY ILD MOGĄ MIEĆ NIEKORZYSTNY WPŁYW NA JAKOŚĆ ŻYCIA PACJENTÓW Z SSc‑ILD3-6
Objawy takie jak kaszel i duszność mogą pogarszać jakość życia pacjentów i negatywnie wpływać na ich zdolność do wykonywania czynności życia codziennego21
Objawy SSc‑ILD mogą w istotny sposób przyczyniać się do obniżenia jakości życia21,22




U pacjentów z SSc-ILD występuje uczucie zmęczenia, depresja, a także istotny wpływ na samopoczucie i produktywność.22
Objawy ILD mogą mieć niekorzystny wpływ na jakość życia pacjentów22
| Wpływ na samopoczucie | Utrata produktywności | Potrzeba wsparcia |
| U 22,6% pacjentów z SSc-ILD występuje depresja | 40,4% pacjentów z SSc-ILD przedwcześnie przechodzi na emeryturę | 2,0% pacjentów z SSc-ILD potrzebuje pomocy płatnego opiekuna (np. pielęgniarki) |
| U 40,3% pacjentów z SSc występuje uczucie zmęczenia | 11,9 roku pomiędzy rzeczywistym przejściem na emeryturę a ustawowym wiekiem emerytalnym | 37,7% pacjentów z SSc-ILD potrzebuje wsparcia ze strony niepłatnego opiekuna (np. członka rodziny) |
| U 44,7% pacjentów z rozległą SSc-ILD występuje trwała niepełnosprawność (8,5% w ograniczonej SSc-ILD) | 22,3 godziny pracy, które nieodpłatni opiekunowie poświęcają tygodniowo pacjentowi z SSc-ILD | |
| 29,3% pacjentów z rozległą SSc-ILD traci pracę z powodu choroby (5% w ograniczonej SSc-ILD) | 100% panelistów zgadza się z tym, że choroba niekorzystnie wpływa na jakość życia nieodpłatnych opiekunów |
Na podstawie: Wuyts W, et al. 2020. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
Krzywe przeżycia dla nagłego zaostrzenia ILD w SSc‑ILD w badaniu japońskim23
AE-ILD było istotnym predyktorem niekorzystnego wyniku w SSc-ILD (p=0,0013).
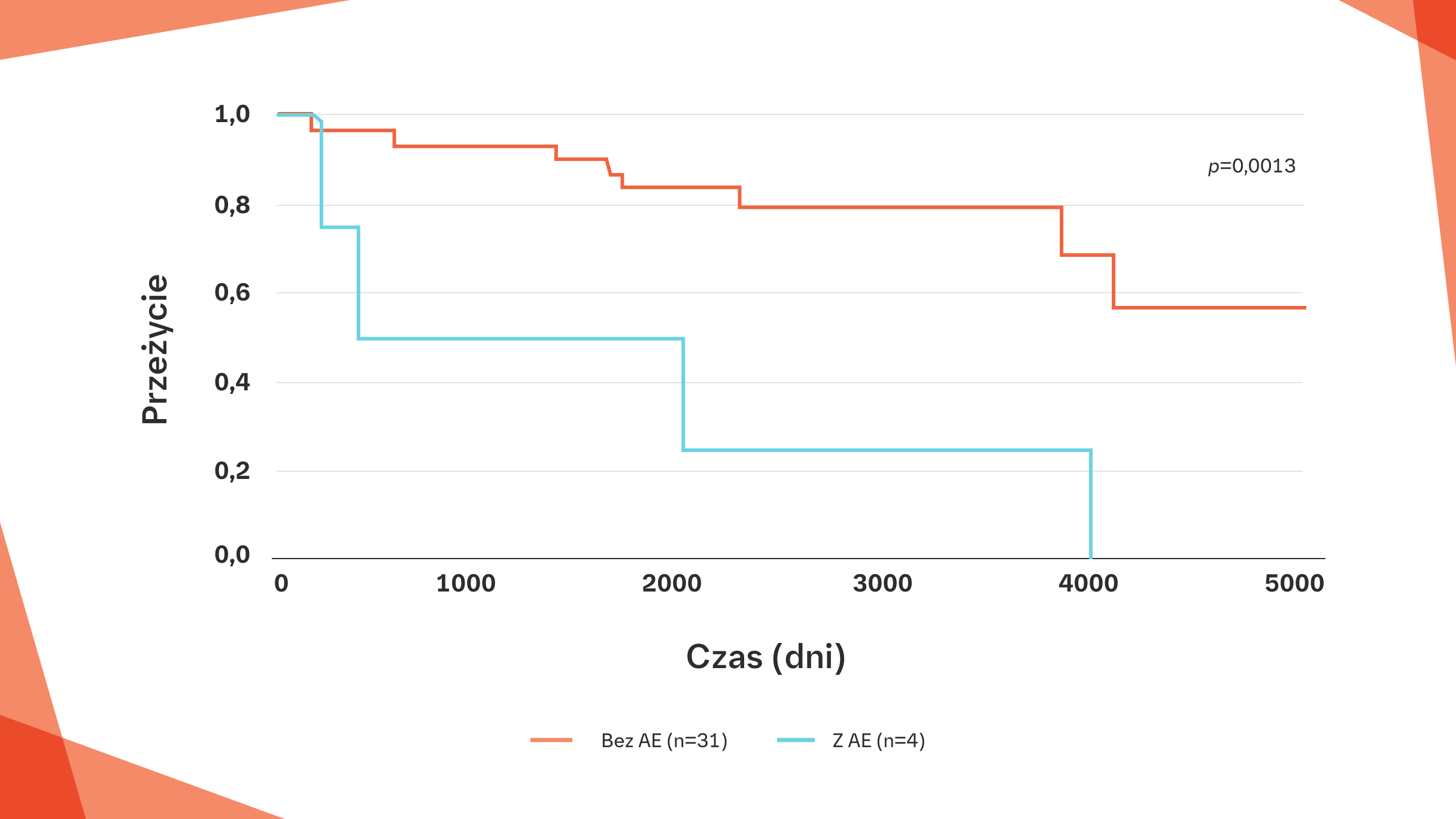
Na podstawie: Okamoto M, et al. 2016;54;445-453.
W jaki sposób można identyfikować i leczyć ILD u pacjentów z SSc?

Badania przesiewowe
w kierunku ILD w SSc
rozpoznania SSc‑ILD
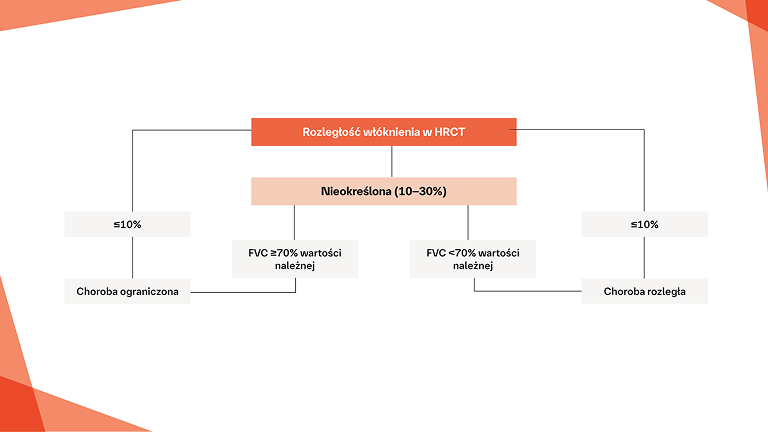
Rozpoznanie SSc‑ILD
w przebiegu SSc
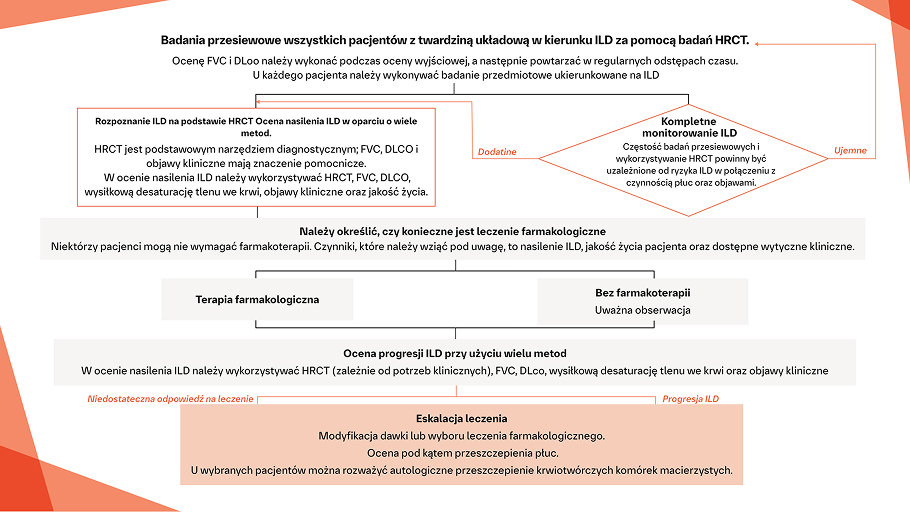
Leczenie SSc‑ILD
Przypisy
-
AE: nagłe zaostrzenie; CI: przedział ufności; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; DM: zapalenie skórno-mięśniowe; FVC: natężona pojemność życiowa; HR: współczynnik ryzyka; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; KL-6: Krebs von den Lungen-6; PM: zapalenie wielomięśniowe; SMR: standardowy wskaźnik śmiertelności; SSc: twardzina układowa; SSc-ILD: śródmiąższowa choroba płuc związana z twardziną układową; UIP: zwykłe śródmiąższowe zapalenie płuc.
-
Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69;1809–1815.
-
Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum D. 2007;66;940–944.
-
Cheng JZ, Wilcox PG, Glaspole I, et al. Cough is less common and less severe in systemic sclerosis-associated interstitial lung disease compared to other fibrotic interstitial lung diseases: Cough severity in fibrotic ILD. Respirology. 2017;22:1592–1597.
-
Tashkin D, Volkmann E, Tseng C et al. Improved cough and cough-specific quality of life in patients treated for scleroderma-related interstitial lung disease results of scleroderma lung study II. Chest. 2017;151(4):813–820.
-
Baron M, Sutton E, Hudson M, et al. The relationship of dyspnoea to function and quality of life in systemic sclerosis. Ann Rheum Dis. 2008;67; 644–650.
-
Theodore AC, Tseng CH, Li N, E et al. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the scleroderma lung study. Chest. 2012;142;614–21.
-
Pope JE, Quansah K, Kolb M, et al. Systemic sclerosis (SSc) with interstitial lung disease (SSc-ILD) in Canada’s largest province: an estimate of the prevalence and survival of SSc and SSc-ILD in Ontario over 10 years. Poster presented at the 6th Systemic Scelerosis World E-Congress 2020.
-
Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
-
Goh NS, Desai SR., Veeraraghavan S, et al. Interstitial lung disease in systemic sclerosis: a simple staging system. Am J Respir Crit Care Med. 2008;177:1248–1254.
-
Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2 e71–e83.
-
Asano Y, Jinnin M, Kawaguchi Y, et al. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45;633–691.
-
Guler, S.A., Winstone, T.A., Murphy, D., et al. Does systemic sclerosis–associated interstitial lung disease burn out? Specific phenotypes of disease progression. Annals ATS. 2018;15;1427–1433.
-
Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis- associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020. Epub ahead of print: doi:10.1136/annrheumdis-2020-217455.
-
Goh NS, Hoyles RK, Denton CP, et al. Short-term pulmonary function trends are predictive of mortality in interstitial lung disease associated with systemic sclerosis. Arthritis Rheumatol. 2017;69;1670–1678.
-
Perelas A, Silver RM, Arrossi AV, et al. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8;304–320.
-
Volkmann ER, Tashkin DP, Sim M. et al. Short-term progression of interstitial lung disease in systemic sclerosis predicts long-term survival in two independent clinical trial cohorts. Ann Rheum Dis. 2019;78(1);122–130.
-
Mayes M, Lacey J, Beebe-Dimmer J et al. Prevalence, incidence, survival, and disease characteristics of systemic sclerosis in a large US population. Arthritis Rheum. 2003;48:2246–2255.
-
Morisset J, Vittinghoff E, Elicker BM, et al. Mortality risk prediction in scleroderma-related interstitial lung disease: the SADL model. Chest. 2017;152(5):999–1007.
-
Suliman YA, Dobrota R, Huscher D, et al. Brief Report: Pulmonary Function Tests: High Rate of False-Negative Results in the Early Detection and Screening of Scleroderma-Related Interstitial Lung Disease. Arthritis Rheumatol. 2015;67;3256–3261.
-
Volkmann ER, Tashkin DP. Treatment of systemic sclerosis–related interstitial lung disease: a review of existing and emerging therapies. Annals ATS. 2016;13;2045–2056.
-
Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
-
Wuyts W, Romild Davidson J, Kilpelainen M et al. Management and burden of disease of SSc-ILD in eight European countries: Results of the BUILDup project. Poster presented at the 6th Systemic Sclerosis World E-Congress 2020.
-
Okamoto M, Fujimoto K, Sadohara J, et al. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54;445–453.
-
Denton C, Hughes M, Gak N et al. BSR and BHPR guideline for the treatment of systemic sclerosis. Rheumatology. 2016;55;1906–1910.
-
Roofeh D, Jaafar S, Vummidi D, et al. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31;241–249.
-
Fischer A, Patel NM, Volkmann ER. Interstitial lung disease in systemic sclerosis: focus on early detection and intervention. OARRR. 2019;11;283–307.
Materiały dla pacjentów po angielsku