Zależność pomiędzy stanem zapalnym i zwłóknieniem w CTD‑ILD
Niezależnie od czynnika wywołującego uszkodzenie płuc, włókniejąca śródmiąższowa choroba płuc w przebiegu choroby tkanki łącznej (CTD‑ILD) wykazuje podobieństwa w mechanizmach patogenetycznych prowadzących do włóknienia1-3

PATOGENEZA CTD‑ILD OBEJMUJE WZAJEMNE ODDZIAŁYWANIE STANU ZAPALNEGO I WŁÓKNIENIA NA WCZESNYM ETAPIE PRZEBIEGU CHOROBY4-6
WSPÓLNE MECHANIZMY PATOGENNE WŁÓKNIENIA PŁUC W CTD‑ILD
Poznaj mechanizmy patofizjologiczne występujące w wielu różnych włókniejących CTD-ILD, w których może rozwinąć się fenotyp postępującego włóknienia
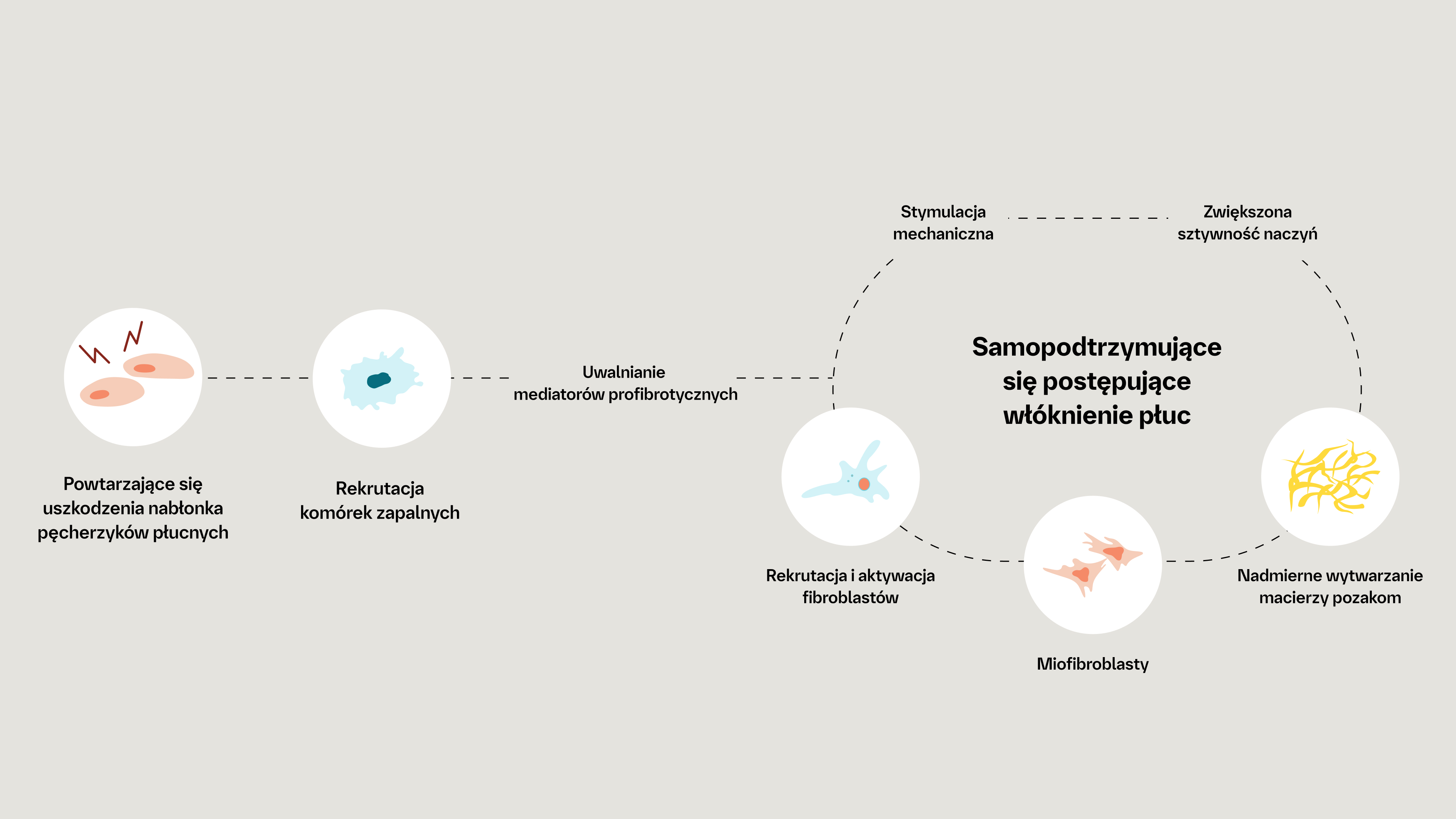
The pathogenesis of fibrotic interstitial lung disease in connective tissue diseases involves a complex interplay of inflammatory and fibrotic processes. Patients with connective tissue diseases (CTDs), such as rheumatoid arthritis, systemic sclerosis and primary Sjogren’s syndrome, develop fibrotic interstitial lung disease (ILD) via common pathogenic processes, irrespective of the underlying diagnosis or trigger. Fibrotic ILD often develops early in the course of a CTD. For example, in a study of systemic sclerosis patients, approximately 24% of systemic sclerosis-associated ILD patients showed an extent of more than 10% pulmonary fibrosis on high-resolution computed tomography at their baseline systemic sclerosis diagnosis. At the cellular level, ILD in CTDs is triggered by repeated tissue injury which induces an inflammatory response, and releases probiotic mediators, including VEGF, PDGF and FGF. These contribute to the recruitment and activation of leukocytes and fibroblasts. Resulting in a complex interplay of inflammatory and fibrotic processes. Activation of leukocytes also produces profibrotic mediators leading to further activation of the fibrotic process with excessive secretion of extracellular matrix. Excess extracellular matrix increases lung tissue stiffness, further activating fibroblasts in a feed-forward loop of self-sustaining progressive pulmonary fibrosis. Pulmonary fibrosis causes irreversible destruction and architectural disruption of the lung tissue. Based on the pathogenesis of fibrotic interstitial lung disease in connective tissue diseases, a new treatment paradigm of CTD-ILDs suggests to not only target inflammation but also fibrosis.
Mimo że postacie CTD różnią się między sobą, wspólne są ich szlaki patogenetyczne prowadzące do włóknienia, niezależnie od czynnika wyzwalającego włóknienie płuc1–3,7
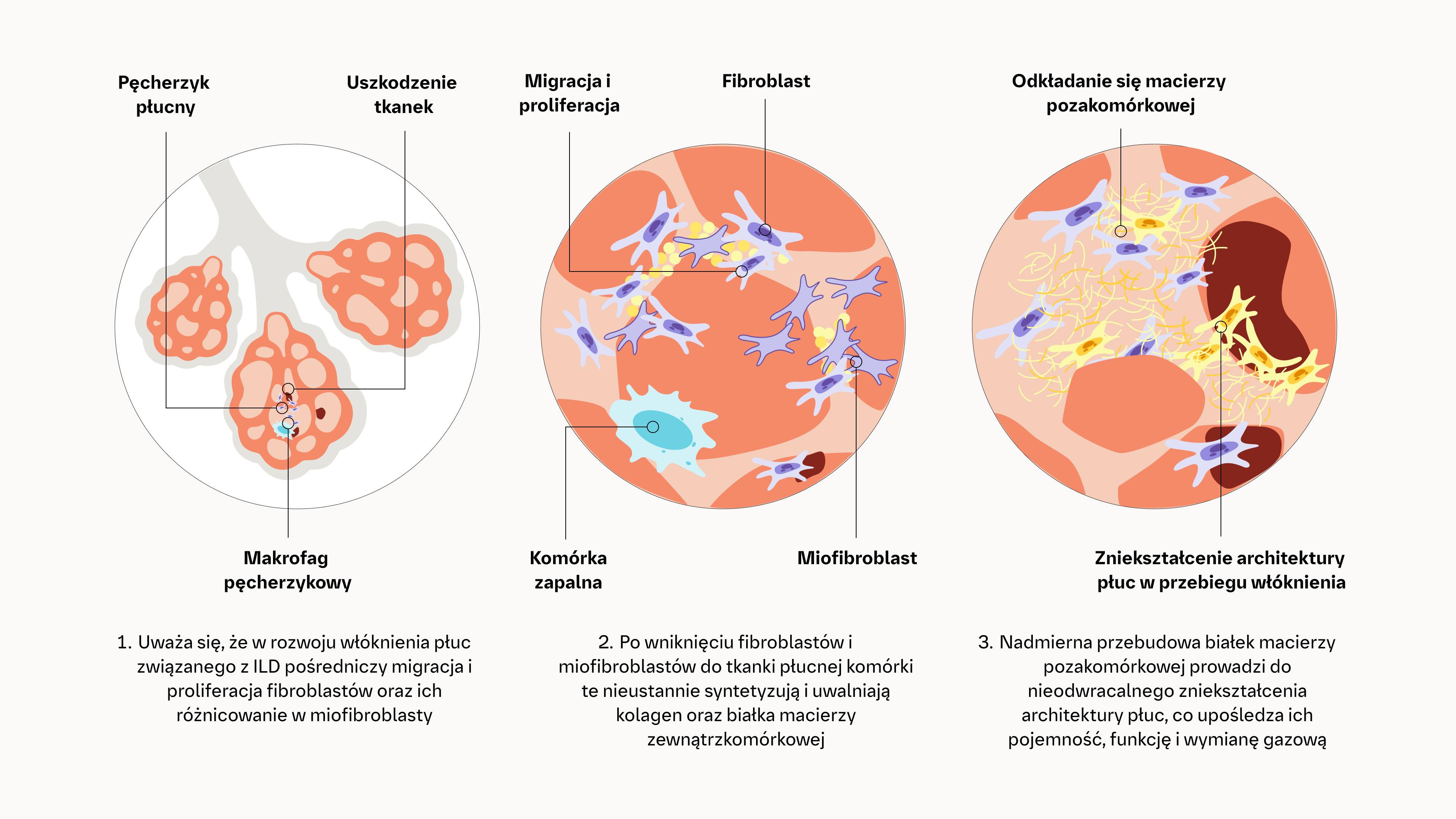
Autoimmunizacja i/lub powtarzające się urazy nabłonka pęcherzyków płucnych i/lub śródbłonka naczyniowego mogą powodować stałą aktywację fibroblastów i postępujący uraz poprzez błędne koła zdarzeń profibrotycznych4,5,8,9
Złożona interakcja procesów zapalnych, fibrotycznych i naczyniowych prowadzi do aktywacji i proliferacji fibroblastów, ich różnicowania w miofibroblasty oraz nadmiernego wydzielania macierzy pozakomórkowej4,5,10
Mechanizmy leżące u podstaw stanu zapalnego i włóknienia w patogenezie CTD‑ILD4,8–16
Jak zidentyfikować włókniejącą ILD możliwie jak najwcześniej u pacjentów z CTD?

Badania przesiewowe w kierunku ILD w przebiegu CTD
Rozpoznanie CTD‑ILD
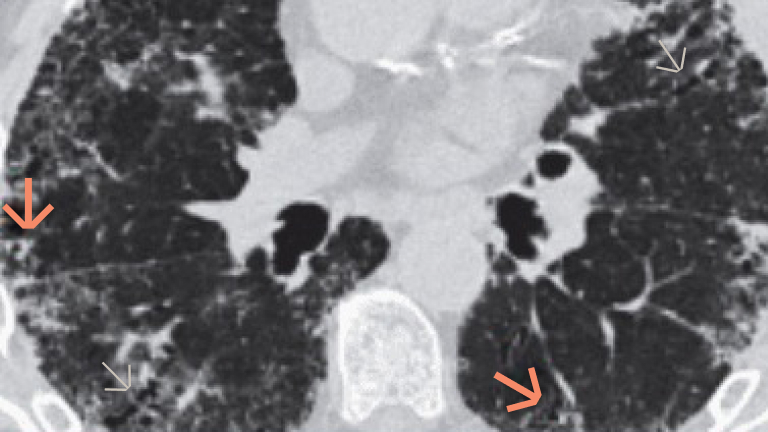
Badanie włókniejącej CTD‑ILD za pomocą obrazowania HRCT
Przypisy
bFGF: podstawowy czynnik wzrostu fibroblastów; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CTGF: czynnik wzrostu tkanki łącznej; EMT: przemiana tkanki nabłonkowej w mezenchymalną; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; MMP: metaloproteinaza macierzy; PDGF: płytkopochodny czynnik wzrostu; PFT: badania czynnościowe płuc; TGF-β: transformujący czynnik wzrostu-β; TNF-α: czynnik martwicy nowotworów-α; TNF-β: czynnik martwicy nowotworów-β; VEGF: czynnik wzrostu śródbłonka naczyniowego.
-
Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
-
Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
-
Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10:728–739.
-
Castelino FV and Varga J. Interstitial lung disease in connective tissue diseases: evolving concepts of pathogenesis and management. Arthritis Res Ther. 2010;12(4):213. doi: 10.1186/ar3097.
-
Dellaripa PF. Interstitial lung disease in the connective tissue diseases; a paradigm shift in diagnosis and treatment. Clin Immunol. 2018;186:71–73.
-
Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. Eur Respir Rev. 2015;24(135):1–16.
-
Cavagna L, Monti S, Grosso V, et al. The multifaceted aspects of interstitial lung disease in rheumatoid arthritis. Biomed Res Int. 2013;2013:759760. doi: 10.1155/2013/759760.
-
Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
-
Cutolo M, Soldano S, Smith V. Pathophysiology of systemic sclerosis: current understanding and new insights. Exp Rev Clin Immunol. 2019;15:753–764.
-
Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2020;201:650–660.
-
Volkmann E, Varga J. Emerging targets of disease-modifying therapy for systemic sclerosis. Nat Rev Rheumatol. 2019;15:208–224.
-
Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder. J Clin Invest. 2007;117:557-567.
-
Bagnato G and Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
-
Nicolosi P A, Tombetti E, Maugeri N, et al. Vascular Remodeling and Mesenchymal Transition in Systemic Sclerosis. Stem Cell Int. 2016; doi: 10.1155/2016/4636859.
-
Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
-
Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in progressive fibrosing interstitial lung diseases. N Engl J Med. 2019;381(18):1718-1727. doi:10.1056/NEJMoa1908681.
-
Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3): 236–245.
Materiały dla pacjentów po angielsku




