Opieka paliatywna/ wspomagająca w CTD‑ILD
Podjęcie działań w zakresie opieki paliatywnej/wspomagającej przynosi korzyści pacjentom ze śródmiąższową chorobą płuc w przebiegu choroby tkanki łącznej1,2

POTRZEBA HOLISTYCZNEGO PODEJŚCIA DO OPIEKI NAD PACJENTAMI Z CTD‑ILD
Opieka paliatywna jest czasem błędnie postrzegana jako obejmująca wyłącznie opiekę u schyłku życia, co może wyjaśniać niedostateczne wykorzystywanie wiedzy specjalistycznej z zakresu opieki paliatywnej nad pacjentami z CTD-ILD.2 Dla pacjentów z ILD w przebiegu CTD dostępna jest szeroka gama metod wspomagających leczenie ILD – od terapii niefarmakologicznych po techniki medytacji „mindfulness”.1–4 Pacjenci z CTD-ILD powinno otrzymywać opiekę paliatywną/wspomagającą, która może obejmować rehabilitację pulmonologiczną, pomoc w rzucaniu palenia lub suplementację tlenu.5
Skuteczne wdrożenie opieki paliatywnej/wspomagającej u pacjentów z CTD-ILD wymaga wielodyscyplinarnego udziału klinicystów, pielęgniarek specjalistycznych, psychologów, pracowników socjalnych, a w niektórych krajach także pozarządowych organizacji wyznaniowych i społecznych, mających dostęp do wiedzy z zakresu opieki paliatywnej.2
Potrzeby pacjentów z postępującą włókniejącą CTD-ILD są podobne do potrzeb pacjentów z chorobami nowotworowymi2
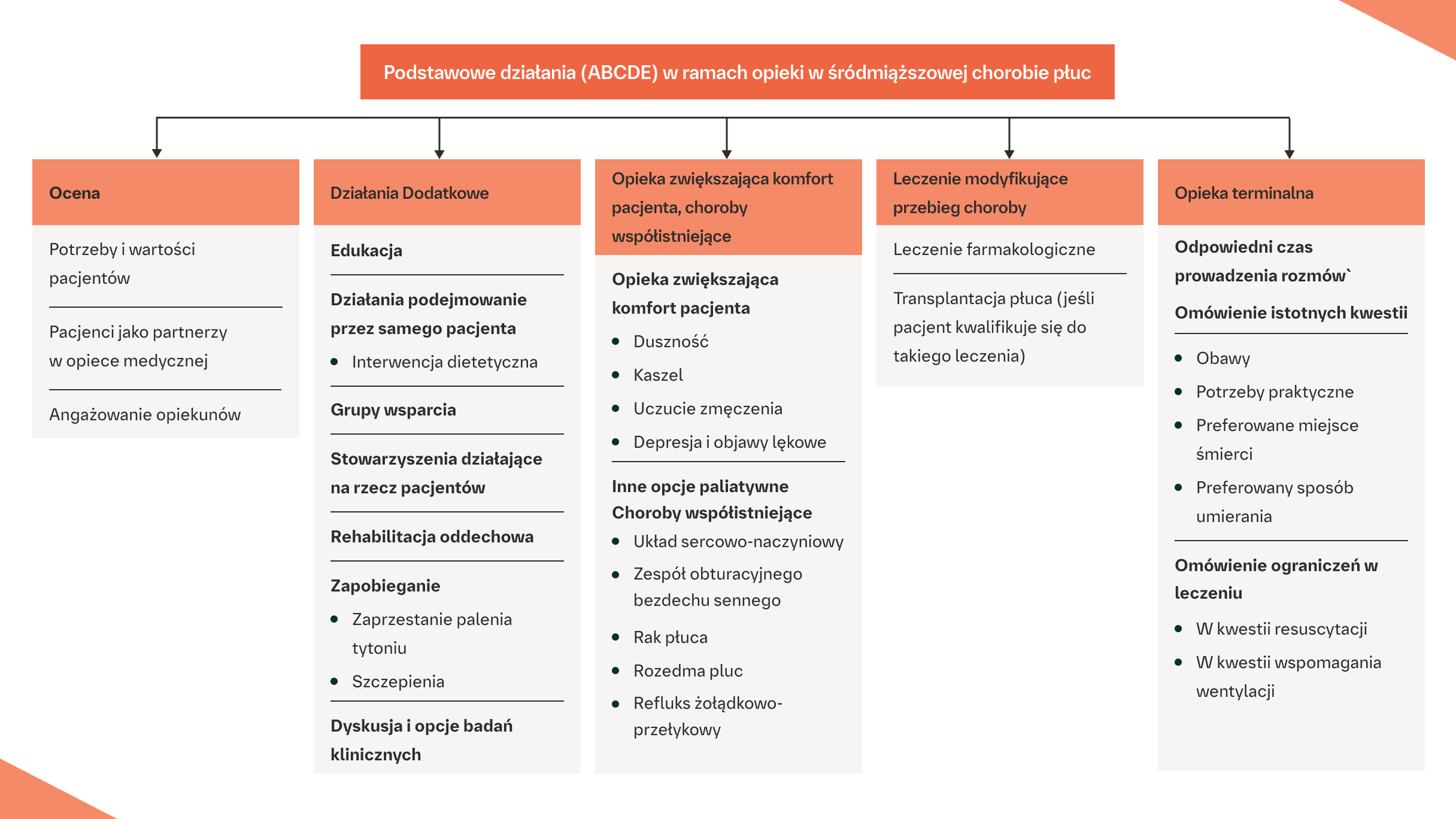
HOLISTYCZNA OPIEKA MAJĄCA NA CELU OPTYMALIZACJĘ JAKOŚCI ŻYCIA POWINNA OBEJMOWAĆ:2




Opieka holistyczna powinna mieć na celu optymalizację jakości życia na każdym etapie ILD2
Na podstawie: Kreuter M, et al. Lancet Respir Med. 2017;5(12):968-980.
REHABILITACJA PULMONOLOGICZNA MOŻE ISTOTNIE POPRAWIAĆ WYDOLNOŚĆ CZYNNOŚCIOWĄ ORAZ JAKOŚĆ ŻYCIA U PACJENTÓW Z ILD:1*




Rehabilitacja pulmonologiczna istotnie poprawia jakość życia, zmniejsza duszność i depresję u pacjentów z ILD1
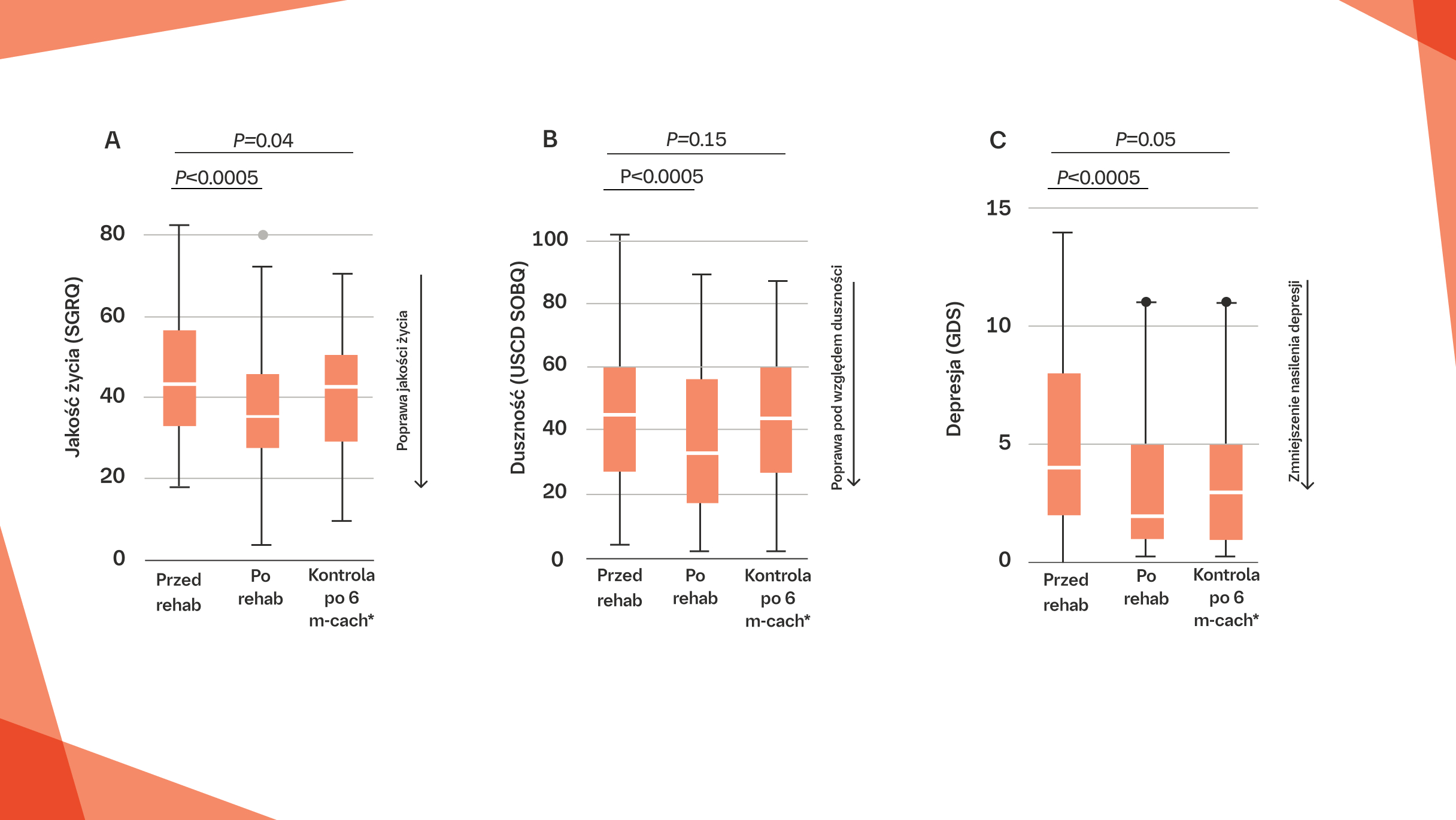
Na podstawie: Ryerson CJ, et al. Respir Med. 2014;108(1 ):203-210.
Wykresy pudełkowe dla (A) jakości życia, (B) duszności i (C) depresji, porównujące wartości przed rehabilitacją pulmonologiczną z wartościami po rehabilitacji pulmonologicznej oraz po.
6-miesięcznej obserwacji. * Dane dotyczące kontroli po 6 miesiącach odnoszą się do pomiarów wykonanych sześć miesięcy po rozpoczęciu rehabilitacji pulmonologicznej.
SUPLEMENTACJA TLENU PODCZAS RUTYNOWYCH CODZIENNYCH CZYNNOŚCI POPRAWIA JAKOŚĆ ŻYCIA PACJENTÓW Z ILD2
DUSZNOŚĆ I AMBULATORYJNA SUPLEMENTACJA TLENU
U pacjentów z włókniejącą ILD z izolowaną hipoksją wysiłkową odnotowano istotne zmniejszenie nasilenia duszności po 2 tygodniach ambulatoryjnej suplementacji tlenu w porównaniu z niestosowaniem takiego leczenia (p<0,0001)6
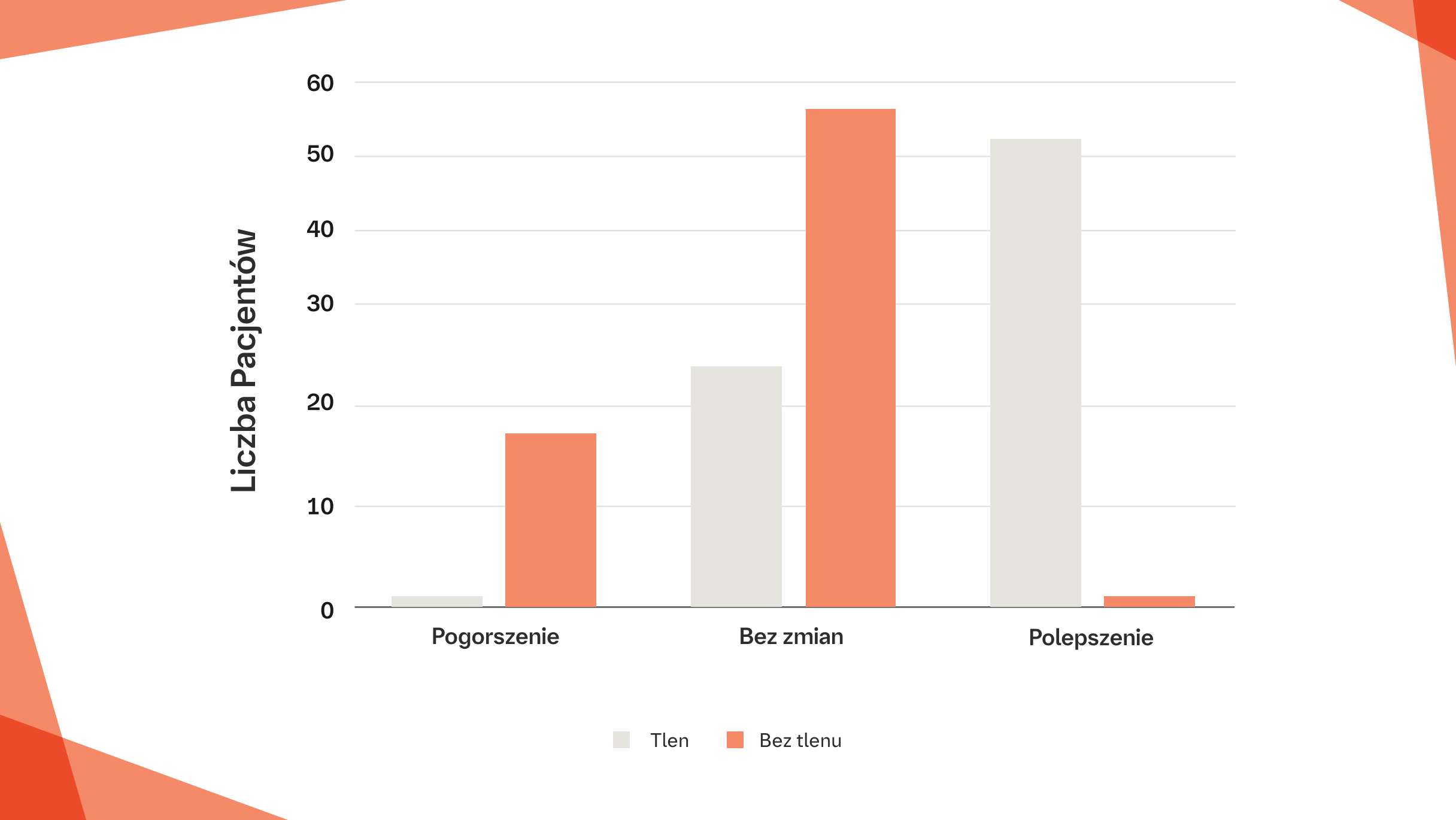
Liczba pacjentów zgłaszających poprawę, stan bez zmian lub pogorszenie pod względem duszności po dwóch tygodniach ambulatoryjnej
suplementacji tlenu bądź niestosowania tlenu6
Na podstawie: Visca D, et al. Lancet Respir Med. 2018;6(10):759-770.
JAKOŚĆ ŻYCIA I AMBULATORYJNA SUPLEMENTACJA TLENU
Ambulatoryjna suplementacja tlenu może istotnie redukować duszność u pacjentów z hipoksją wysiłkową6 – należy zapewnić pacjentom z CTD‑ILD możliwość otrzymania ambulatoryjnej suplementacji tlenu w razie potrzeby
Ambulatoryjne stosowanie tlenu podczas wykonywania codziennych czynności przez 2 tygodnie było związane z istotną poprawą łącznego wyniku w skali K-BILD w porównaniu z niestosowaniem tlenu [55,5 (SD 13,8) w przypadku stosowania tlenu w porównaniu z 51,8 (SD 13,6) bez stosowania tlenu; p<0,0001]6
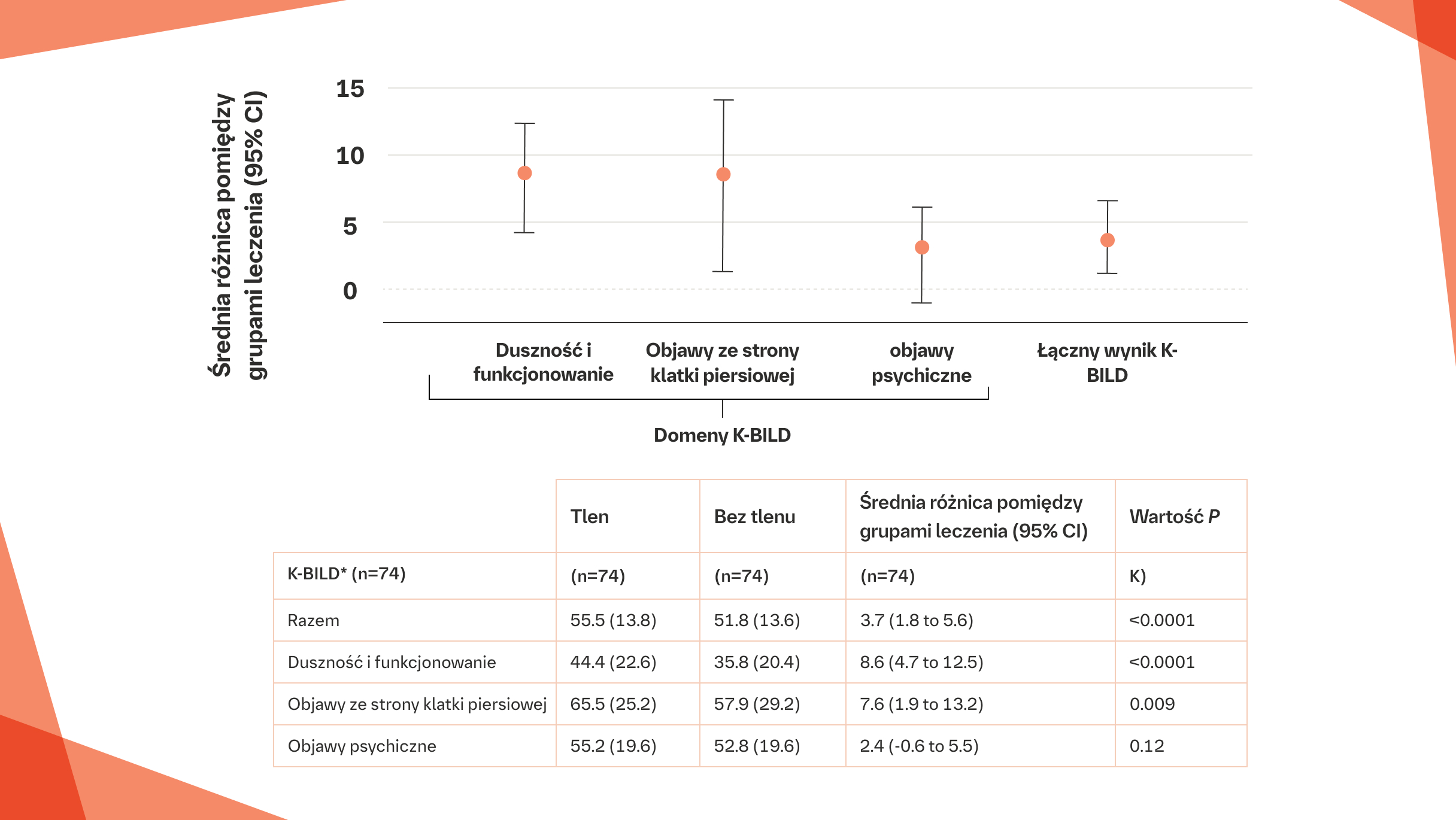
Średnia różnica wyników w skali K-BILD pomiędzy ambulatoryjną suplementacją tlenu a niestosowaniem leczenia, skorygowana o kolejność leczenia.
Na podstawie: Visca D, et at. Lancet Respir Med. 2018;6(10):759-770.
*Wyższe wyniki oznaczają lepszą jakość życia; minimalna klinicznie istotna różnica wyniku w skali K-BILD wynosi 4 (zakres: 3,7–4,21) dla łącznego wyniku, 6 (5,6–8,51) dla podskali duszności i funkcjonowania, 5,4 (4,6–6,91) dla podskali objawów psychologicznych oraz 0,5 (SD 8,9) dla podskali objawów ze strony klatki piersiowej.
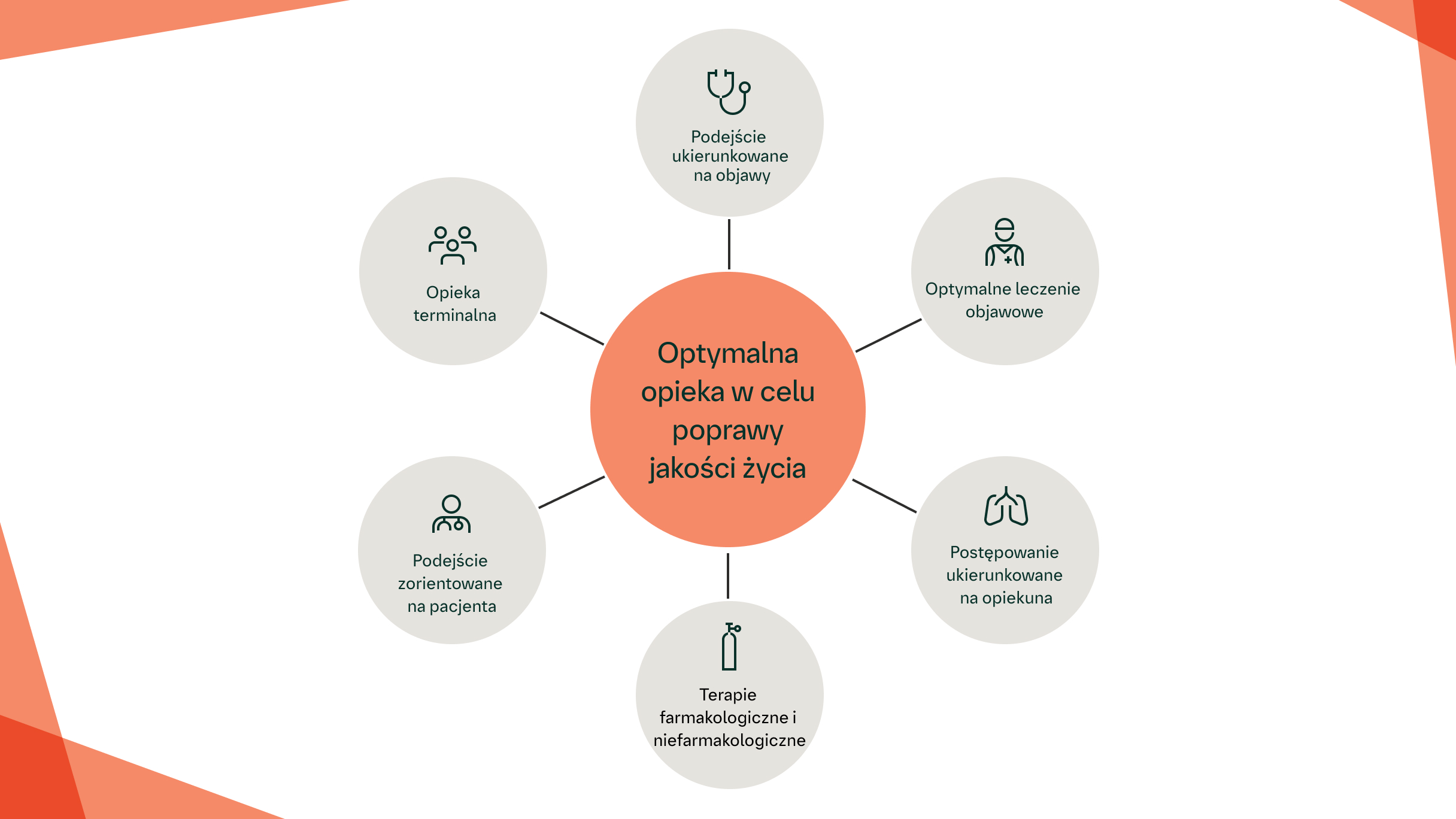
WCZESNA OPIEKA PALIATYWNA MOŻE POMÓC W ŁAGODZENIU OBJAWÓW ORAZ UTRZYMANIU DOBREGO SAMOPOCZUCIA FIZYCZNEGO I EMOCJONALNEGO U PACJENTÓW Z WŁÓKNIEJĄCĄ ILD2
Niemal połowa pacjentów z włókniejącą ILD umiera w szpitalu z powodu niewłaściwego planowania opieki nad chorym.7 W związku z tym warto oferować wszystkim pacjentom z postępującą włókniejącą ILD planowanie opieki z wyprzedzeniem, w tym omówienie ograniczeń w leczeniu oraz preferencje dotyczące końcowego okresu życia u wszystkich pacjentów z włókniejącą ILD.2
Opieka paliatywna jest czasem błędnie postrzegana jako obejmująca wyłącznie opiekę u schyłku życia, co może wyjaśniać niedostateczne wykorzystywanie wiedzy specjalistycznej z zakresu opieki paliatywnej nad pacjentami z włókniejącą ILD.2
Opieka paliatywna odgrywa cenną rolę na wcześniejszym etapie przebiegu ILD – według coraz szerszego konsensusu opiekę paliatywną w ILD należy rozpoczynać wcześnie, a nie zwlekać z nią aż do momentu, gdy ILD będzie w stadium zaawansowanym, co może pomóc uniknąć błędnego przekonania, że opieka paliatywna jest równoznaczna ze zbliżającym się zgonem.2 Strategia postępowania oparta na przebiegu ILD może być pomocna w identyfikacji potrzeb chorych w zakresie opieki paliatywnej ze względu na nieprzewidywalny przebieg większości przypadków włókniejącej ILD.2
Wykazano, że opieka paliatywna obejmująca leczenie farmakologiczne uzupełnione postępowaniem niefarmakologicznym poprawia jakość życia związaną z objawami.2 Wczesna opieka paliatywna powinna być wdrażana u pacjentów, u których ILD przybiera charakter postępujący pomimo optymalnego postępowania medycznego, gdy pacjent odczuwa jawny niepokój lub gdy objawy są uciążliwe.2 Poprawa opieki paliatywnej nad pacjentami z postępującą włókniejącą ILD prawdopodobnie może zmniejszać obciążenie związane z objawami.7
JAKIE SĄ POTRZEBY PACJENTÓW Z ILD W PRZEBIEGU CTD ZWIĄZANE Z OPIEKĄ PALIATYWNĄ?
Algorytm oparty na przebiegu ILD, pomagający klinicystom ocenić bezpośrednią potrzebę opieki paliatywnej u pacjentów z włókniejącą ILD2
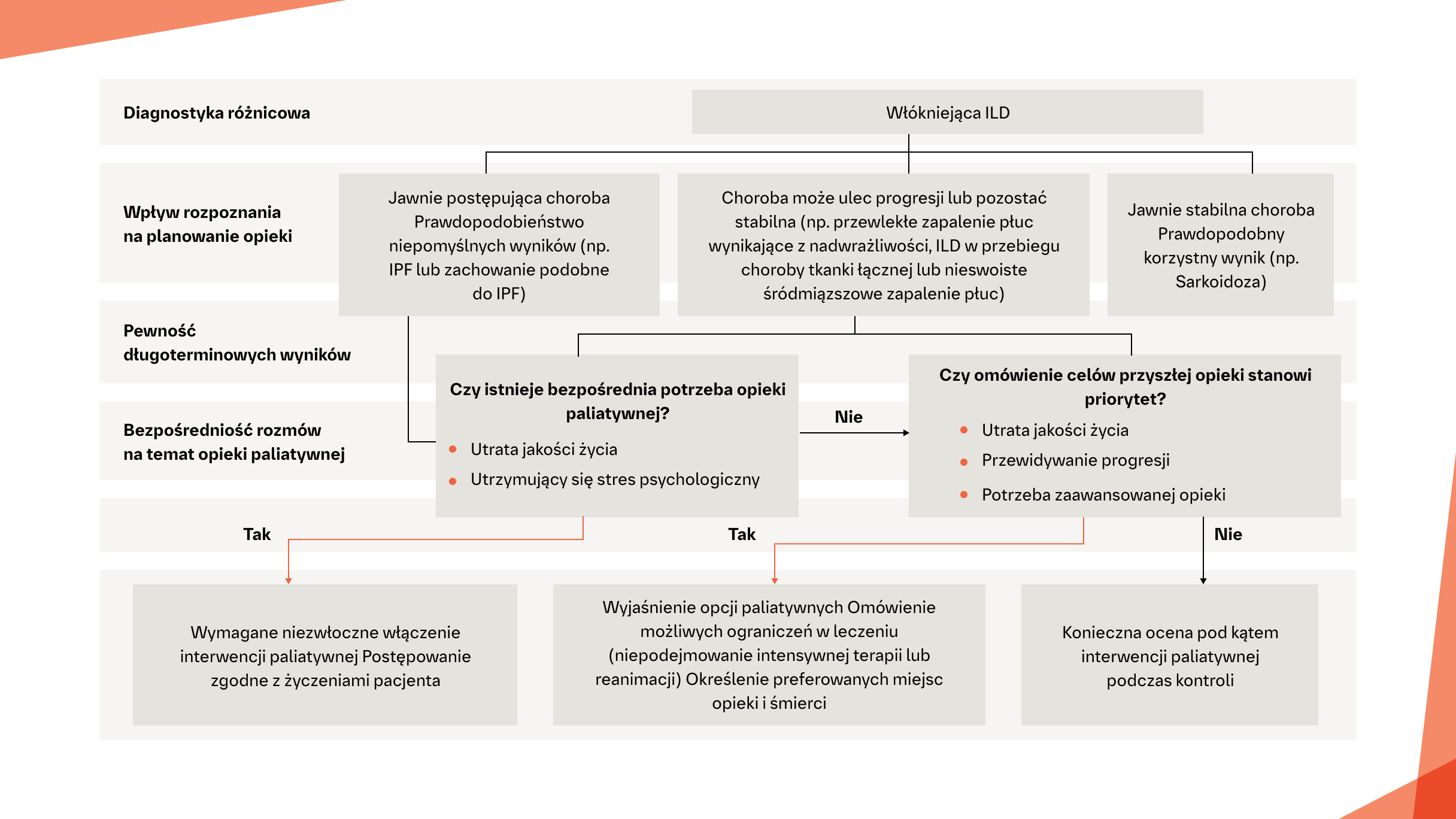
Jak identyfikować u pacjentów ILD w przebiegu CTD możliwie jak najwcześniej i jakie postępowanie należy podejmować?
Rozpoznanie CTD‑ILD

Opisy przypadków pacjentów z CTD‑ILD do oceny przesiewowej i diagnostyki

Zespoły wielodyscyplinarne
Przypisy
-
* Liczby oparte na prospektywnym badaniu kohortowym.
6MWD: dystans w 6-minutowym teście marszowym; ABCDE: ocena – działania dodatkowe – opieka zwiększająca komfort pacjenta, choroby współistniejące – leczenie modyfikujące przebieg choroby – opieka terminalna; CI: przedział ufności; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; ILD: śródmiąższowa choroba płuc; IPF: idiopatyczne włóknienie płuc; K-BILD: krótki kwestionariusz śródmiąższowej choroby płuc Kinga; MCID: minimalna różnica istotna klinicznie; QoL: jakość życia; SD: odchylenie standardowe; SGRQ: kwestionariusz oddechowy szpitala St George.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Geerts S, Wuyts W, Langhe ED, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
-
Visca D, Mori L, Tsipouri V, et al. Effect of ambulatory oxygen on quality of life for patients with fibrotic lung disease (AmbOx): a prospective, open-label, mixed-method, crossover randomised controlled trial. Lancet Respir Med. 2018;6(10):759-770.
-
Ahmadi Z, Wysham N, Lundström S, et al. End-of-life care in oxygen-dependent ILD compared with lung cancer: a national population-based study. Thorax. 2016;71(6):510-516.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
Materiały dla pacjentów po angielsku