Obrazowanie włóknienia płuc metodą HRCT w CTD‑ILD
Tomografia komputerowa wysokiej rozdzielczości (HRCT) stanowi złoty standard, umożliwiając dokładne rozpoznanie śródmiąższowej choroby płuc (ILD) w chorobach tkanki łącznej (CTD)1,2

U PACJENTÓW Z PODEJRZENIEM ILD KLUCZOWE ZNACZENIE MA WYKONANIE BADANIA HRCT KLATKI PIERSIOWEJ1
HRCT stanowi złoty standard z punktu widzenia wiarygodnego rozpoznania lub wykluczenia ILD1,2 Rozległe włóknienie w HRCT sugeruje niekorzystne rokowanie w wielu podtypach CTD-ILD i może dostarczyć dalszych dowodów na stabilność lub pogorszenie u pacjentów z niejasnymi oznakami progresji.1
Jakie czynniki ryzyka wskazują na niekorzystne rokowanie oraz wczesny zgon w CTD-ILD?
Badania przesiewowe w kierunku CTD-ILD mogą przynieść podwójną korzyść, polegającą na rozpoznaniu choroby we wczesnym stadium oraz bardziej swoistym identyfikowaniu pacjentów, u których występuje największe ryzyko progresji i pogorszenia stanu czynnościowego6
RADIOLOG ODGRYWA CENTRALNĄ ROLĘ W ROZPOZNANIU CTD‑ILD WE WSPÓŁPRACY Z REUMATOLOGIEM7
Wywiad kliniczny pacjentów z CTD może pomóc radiologowi w:8
Udziale w dyskusji zespołu wielodyscyplinarnego
Interpretacji cech radiologicznych w badaniu HRCT
Przekazaniu cennych informacji w kontekście rozpoznania różnicowego w przypadku podejrzenia ILD
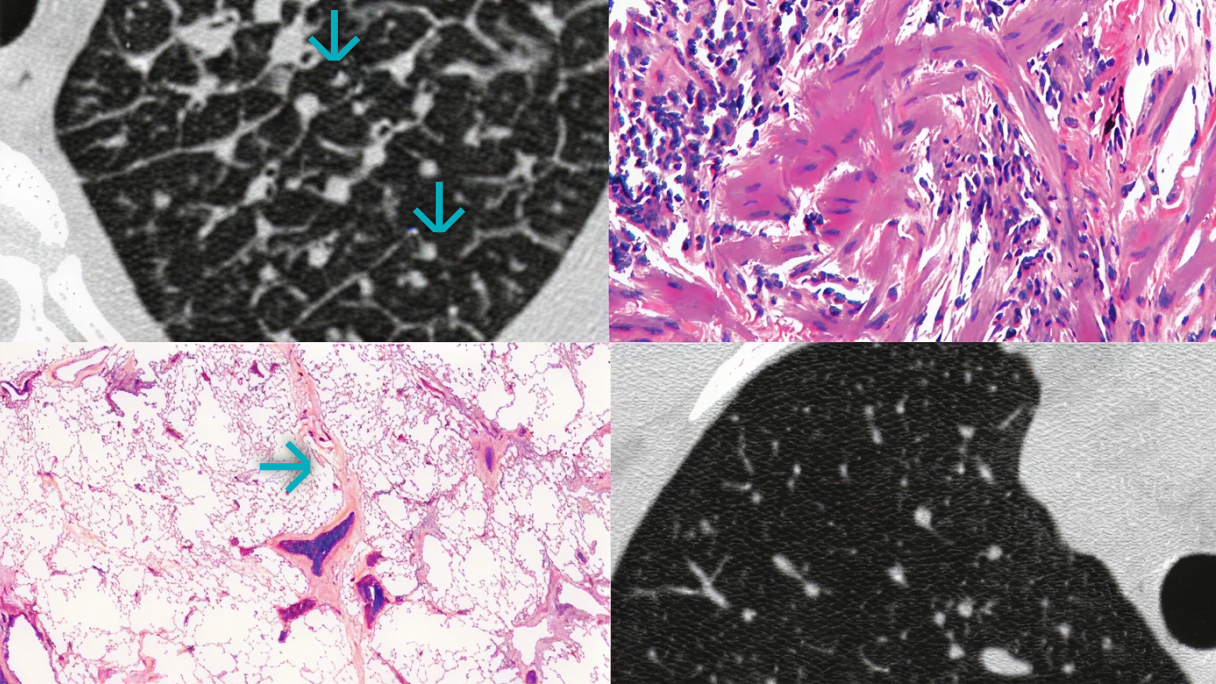
Do typowych cech radiologicznych w badaniu HRCT świadczących o włóknieniu w przebiegu CTD-ILD należą:12,13
Trakcyjne rozstrzenie oskrzeli, którym mogą towarzyszyć zmiany typu „matowego szkła”
Zmiany siateczkowe, którym mogą towarzyszyć zmiany typu „matowego szkła”
Zmiany typu „plastra miodu”, którym mogą towarzyszyć zmiany typu „matowego szkła”
Podstawowy leksykon obrazów HRCT:
Zwykłe śródmiąższowe zapalenie płuc (UIP) charakteryzuje się mniej jednorodnym obrazem radiologicznym, względną zmianą architektury płuc, zmiennym nasileniem zmian związanych z włóknieniem, zmianami typu „plastra miodu” głównie w podstawach płuc oraz podopłucnowymi zmianami siateczkowymi z trakcyjnymi rozstrzeniami oskrzeli12,13
Nieswoiste śródmiąższowe zapalenie płuc (NSIP) charakteryzuje się bardziej jednorodnym obrazem radiologicznym, względnym zachowaniem architektury płuc i stosunkowo symetrycznymi podopłucnowymi zmianami typu „matowego szkła” z oszczędzeniem bezpośredniej strefy podopłucnowej12,13
Limfoidalne śródmiąższowe zapalenie płuc (LIP) charakteryzuje się rozproszonymi, cienkościennymi torbielami i zmianami typu „matowego szkła”12
U większości pacjentów z SSc-ILD w obrazie HRCT występuje wzorzec włóknienia typowy dla NSIP, ze znacznym odsetkiem zmian typu „matowego szkła”, a także z obecnością zmian siateczkowych i trakcyjnych rozstrzeni oskrzeli, choć u niewielkiego odsetka pacjentów może występować wzorzec UIP.14,15
UIP jest najczęstszym wzorcem HRCT w RZS-ILD, charakteryzującym się zmianami siateczkowymi, zmianami typu „plastra miodu” i trakcyjnymi rozstrzeniami oskrzeli.16
Poznaj rolę HRCT w badaniach przesiewowych i diagnostyce CTD‑ILD

Badania przesiewowe w kierunku ILD w przebiegu CTD
Rozpoznanie CTD‑ILD

Opisy przypadków pacjentów z CTD‑ILD do oceny przesiewowej i diagnostyki
Przypisy
-
CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; HP: zapalenie płuc związane z nadwrażliwością; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILA: śródmiąższowe nieprawidłowości w płucach; ILD: śródmiąższowa choroba płuc; LIP: limfoidalne śródmiąższowe zapalenie płuc; MCTD-ILD: śródmiąższowa choroba płuc związana z mieszaną chorobą tkanki łącznej; NSIP: nieswoiste śródmiąższowe zapalenie płuc; PFT: badania czynnościowe płuc; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; SSc: twardzina układowa; SSc-ILD: śródmiąższowa choroba płuc związana z twardziną układową; TK: tomografia komputerowa; UIP: zwykłe śródmiąższowe zapalenie płuc.
-
Geerts S, Wuyts W, de Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Wells AU, Brown KK, Flaherty KR, et al. What’s in a name? That which we call IPF, by any other name would act the same. Eur Respir J. 2018;51(5):1800692.
-
Gulati M. Diagnostic assessment of patients with interstitial lung disease. Prim Care Respir J. 2011;20:120–127.
-
Greiffo FR, Eickelberg O, Fernandez IE. Systems medicine advances in interstitial lung disease. Eur Respir Rev. 2017;26:170021.
-
Fischer A, Strek ME, Cotton V, et al. Proceedings of the American College of Rheumatology/Association of Physicians of Great Britain and Ireland Connective Tissue Disease–Associated Interstitial Lung Disease Summit: a multidisciplinary approach to address challenges and opportunities. Arthritis Rheumatol. 2019;71(2):182–195.
-
De Lorenzis E, Bosello SL, Varone F, et al. Multidisciplinary evaluation of interstitial lung diseases: new opportunities linked to rheumatologist involvement. Diagnostics (Basel). 2020;10(9):664.
-
Chung J, Goldin J. Interpretation of HRCT scans in the diagnosis of IPF: improving communication between pulmonologists and radiologists. Lung. 2018;196(5):561–567.
-
Sverzellati N, Odone A, Silva M, et al. Structured reporting for fibrosing lung disease: a model shared by radiologist and pulmonologist. Radiol Med. 2018;123(4):245–253.
-
Irion KL, Souza Jr AS, Marchiori E, da Silveira Dalla-Bona JP, Hochhegger B. Assessment of pulmonologists’ receptivity to a structured radiology report for interstitial lung disease. J Bras Pneumol. 2020;46(5):e20200164.
-
Berkowitz EA, Bernheim A, Little BP. Introducing ILD-RADS: a pilot study of an interstitial lung disease standardized reporting template. J Am Coll Radiol. 2019;16(9 Pt A):1169–1172.
-
Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
-
Denton CP, Wells AU, Coghlan JG. Major lung complications of systemic sclerosis. Nat Rev Rheumatol. 2018;14:511–527.
-
Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Perelas A, Silver RM, Arrossi AV, et al. Systemic sclerosis-associated interstitial lung disease. Lancet Respir Med. 2020;8(3):304–320.
-
Iqbal K, Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Dawson JK, Fewins HE, Desmond J, et al. Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis. 2002;61:517–521.
-
Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Yamakawa H, Sato S, Tsumiyama E, et al. Predictive factors of mortality in rheumatoid arthritis-associated interstitial lung disease analysed by modified HRCT classification of idiopathic pulmonary fibrosis according to the 2018 ATS/ERS/JRS/ALAT criteria. J Thorac Dis. 2019;11(12):5247–5257.
-
Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.
Materiały dla pacjentów po angielsku