Włókniejące CTD‑ILD o fenotypie postępującym
Nawet u 4 na 10 pacjentów ze śródmiąższową chorobą płuc w przebiegu choroby tkanki łącznej (CTD-ILD) może rozwinąć się fenotyp postępującego włóknienia1–5

W postępującej włókniejącej ILD włóknienie płuc stale się rozwija, niezależnie od choroby podstawowej (SSc, RZS, pierwotnego zespołu Sjögrena itp.) lub czynnika wyzwalającego (stan zapalny, narażenie na określone czynniki itp.), przy zachowaniu wspólnych szlaków patogenetycznych6,9–11
CZĘSTOŚĆ WYSTĘPOWANIA FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA U PACJENTÓW Z CTD‑ILD
Szacuje się, że u 16%–40% pacjentów z CTD‑ILD rozwija się fenotyp postępującego włóknienia – wartości te określono na podstawie systematycznego przeglądu opublikowanej literatury oraz badania ankietowego wśród lekarzy1–5
| Włókniejąca ILD | Odsetek pacjentów z fenotypem postępującym, % | Piśmiennictwo / źródło |
| Śródmiąższowa choroba płuc w przebiegu reumatoidalnego zapalenia stawów (RZS-ILD) | 40 | Zamora-Legoff 2017 |
| Śródmiąższowa choroba płuc w przebiegu twardziny układowej (SSc-ILD | 32 | Hoffmann-Vold 2015 |
| Śródmiąższowa choroba płuc związana z zapaleniem wielomięśniowym i zapaleniem skórno-mięśniowym (PM/DM-ILD) | 16 | Marie 2011 |
| Śródmiąższowa choroba płuc związana z pierwotnym zespołem Sjögrena (ILD związana z pierwotnym zespołem Sjögrena) | 24 | Wijsensbeek 2019* |
| Śródmiąższowa choroba płuc związana z toczniem rumieniowatym układowym (SLE-ILD) | 24 | Wijsensbeek 2019* |
| Śródmiąższowa choroba płuc związana z mieszaną chorobą tkanki łącznej (MCTD-ILD) | 24 | Wijsensbeek 2019* |
* Dane szacunkowe dotyczące odsetka pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród łącznie 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii. Źródłowe wartości procentowe (24%) dla ILD związanej z pierwotnym zespołem Sjögrena, SLE-ILD i MCTD-ILD pochodziły z tej samej grupy „Inne CTD-ILD”.
OBCIĄŻENIE ZWIĄZANE Z POSTĘPUJĄCĄ WŁÓKNIEJĄCĄ CTD‑ILD MOŻE ZNACZNIE ZREDUKOWAĆ JAKOŚĆ ŻYCIA PACJENTA UWARUNKOWANĄ STANEM ZDROWIA9
Kaszel i duszność niekorzystnie wpływają na codzienne życie pacjentów z CTD‑ILD15–17
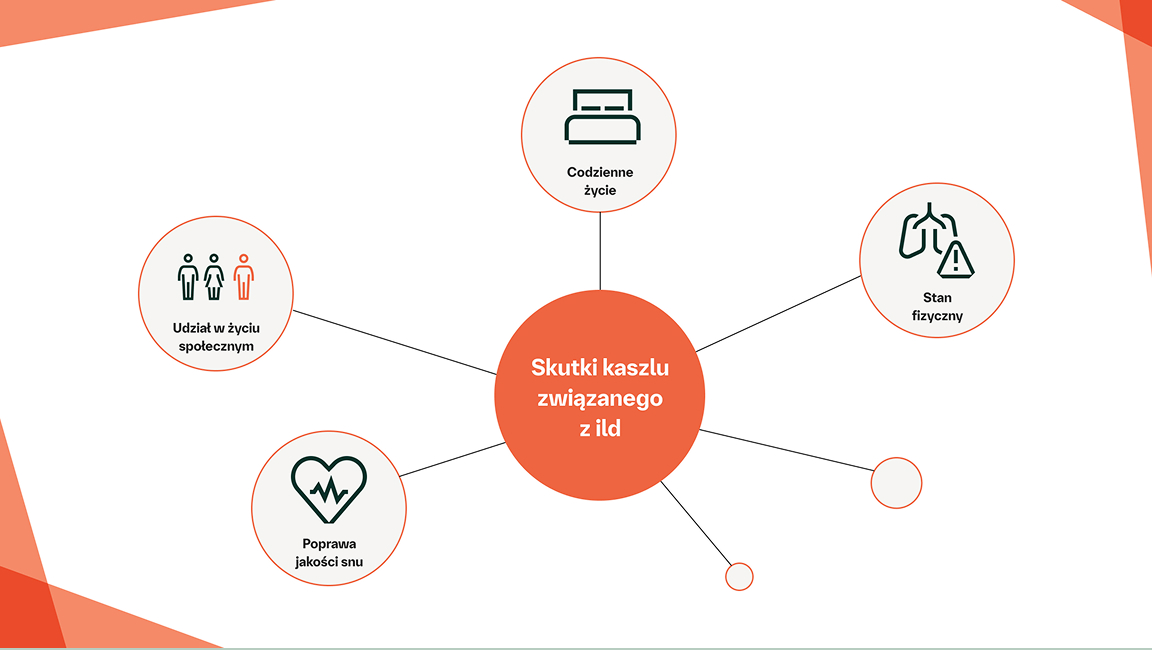
Pacjenci z postępującą CTD-ILD cierpią z powodu zaburzeń emocjonalnych, które mogą obejmować uczucia depresji, lęku i utraty niezależności18,19




POSTĘPUJĄCA CTD‑ILD MOŻE POTENCJALNIE WPŁYWAĆ NA ŻYCIE PACJENTÓW NA WIELU PŁASZCZYZNACH7,18
Pacjenci z postępującą CTD-ILD niemal zawsze zgłaszają objawy lęku i/lub depresji18
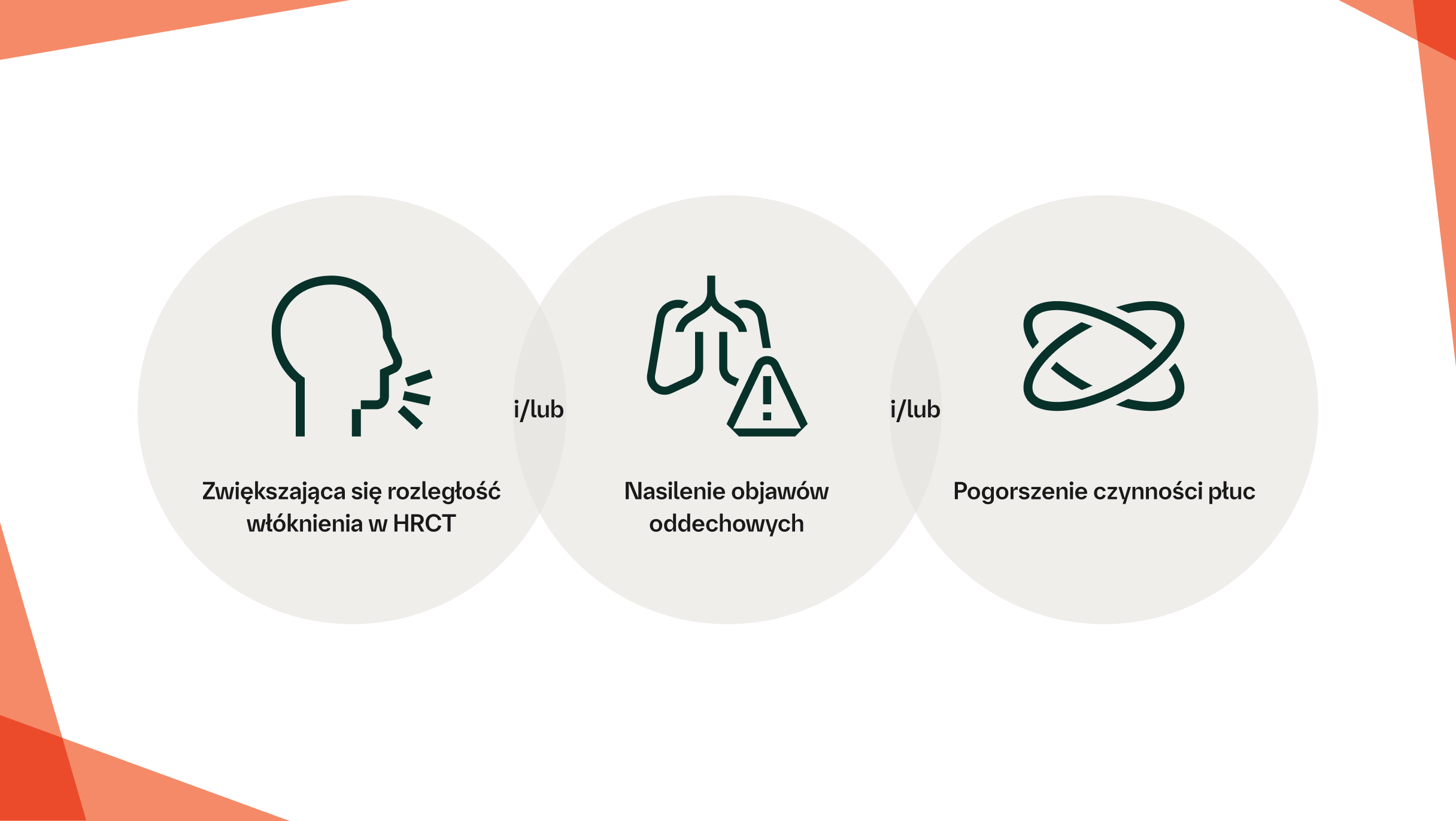
Postępująca włókniejąca ILD charakteryzuje się progresją włóknienia płuc, nasileniem objawów, pogorszeniem czynności płuc i obniżeniem jakości życia uwarunkowanej stanem zdrowia7
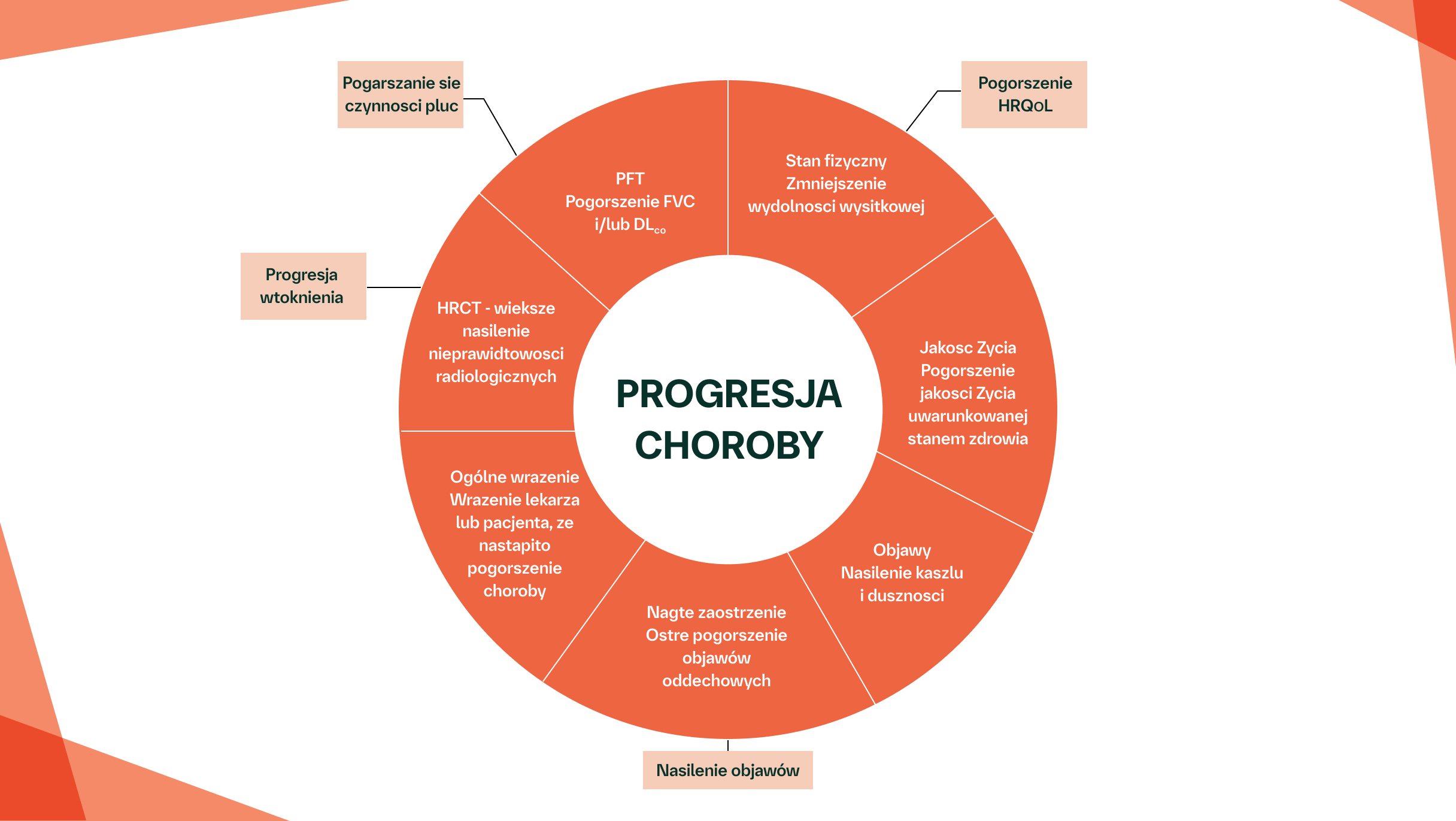
Czynniki odzwierciedlające progresję ILD
Na podstawie: Kolb M, Vašáková M. Respir Res. 2019;20(1).
Pogorszenie czynności płuc wykazane w PFT jest związane ze zwiększoną śmiertelnością wśród pacjentów z CTD-ILD14,20–22
ODKRYJ WSZYSTKIE SKUTKI POSTĘPUJĄCEJ WŁÓKNIEJĄCEJ CTD‑ILD
Zobacz skutki postępującej włókniejącej ILD w przebiegu różnych CTD-ILD
Patients with interstitial lung diseases face an unpredictable journey. There are over 200 types of ILDs, of which Idiopathic pulmonary fibrosis, or IPF, is the most common fibrosing type. Around 1 in 5 patients with differing ILD diagnoses may develop a ‘progressive fibrosing phenotype’. Progressive fibrosing ILDs are believed to progress via common pathobiological fibrotic pathways, independent of the original trigger. These progressive fibrosing ILDs are characterised by self-sustaining, diffuse and irreversible fibrosis, worsening respiratory symptoms and declining lung function. The progressive and permanent fibrotic lung damage can place an overwhelming burden on patient’s quality of life and is associated with high mortality. No treatments are currently approved for progressive fibrosing ILDs, other than IPF. Thus, there is a high unmet need for effective treatments that slow the disease progression in these patients. Boehringer Ingelheim has a strong commitment to scientific research. The INBUILD® clinical trial is the first and largest phase III global trial to include patients across the broad spectrum of ILDs that develop the ‘progressive fibrosing phenotype’, into a single trial. So together, we hope to help patients with progressive fibrosing ILDs find new ways forward.
Pierwszym krokiem do spowolnienia postępującej CTD‑ILD jest identyfkacja ILD
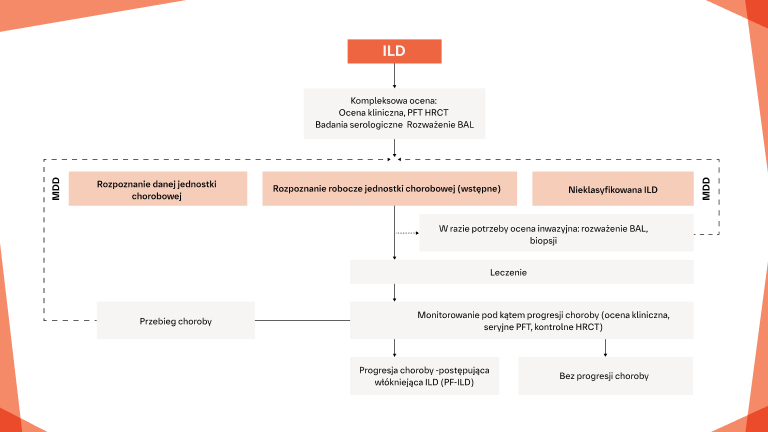
Pierwszym krokiem do spowolnienia postępującej CTD‑ILD jest identyfikacja ILD
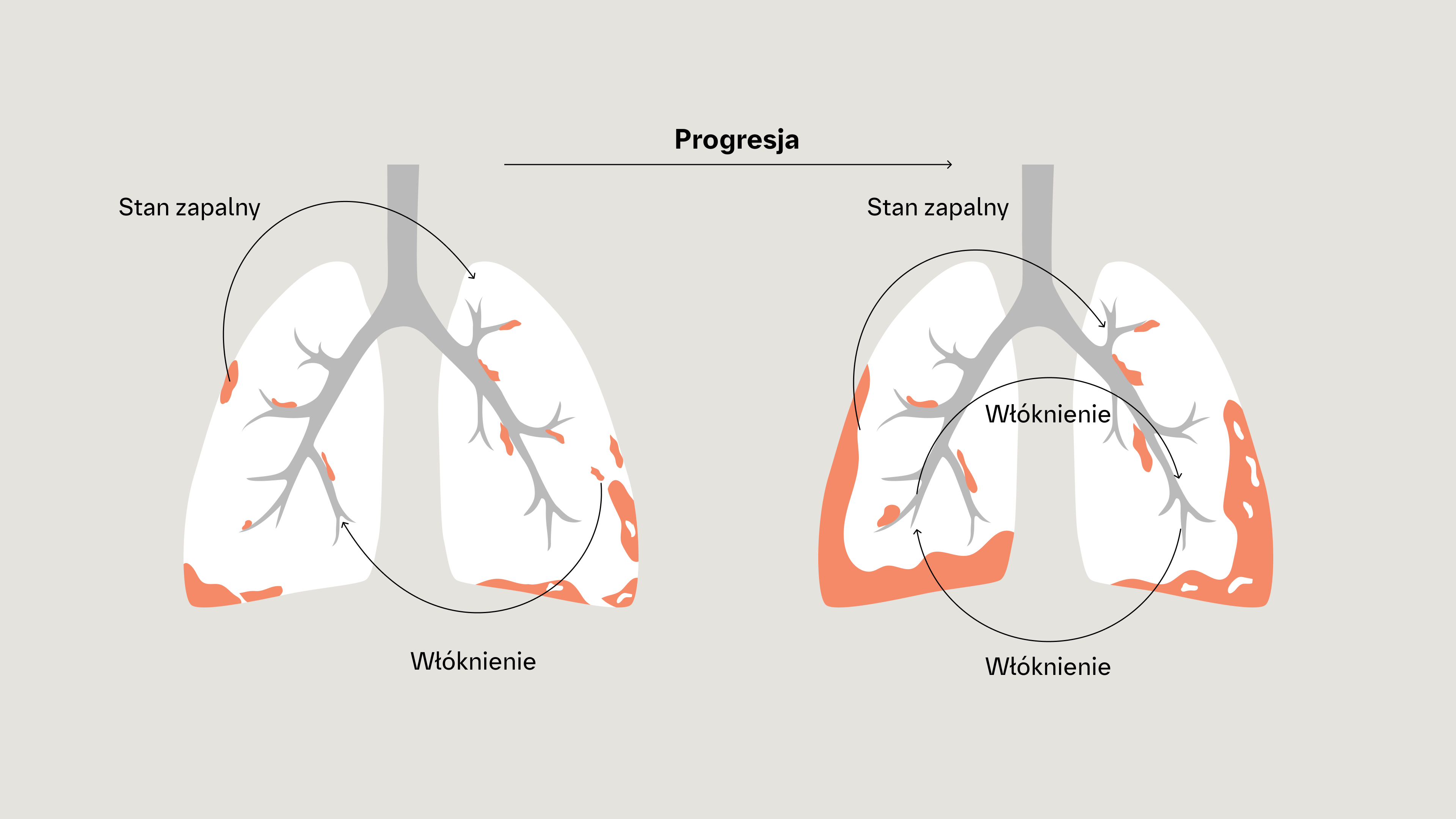
Stan zapalny i włóknienie w CTD‑ILD
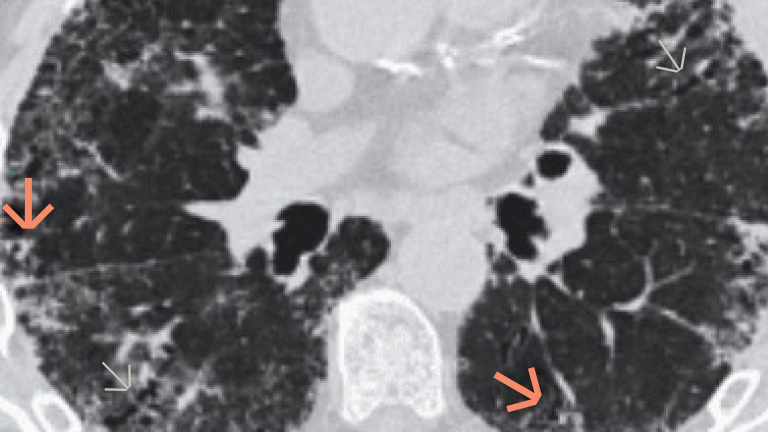
Badanie włókniejącej CTD‑ILD za pomocą obrazowania HRCT
Przypisy
CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; DM-ILD: śródmiąższowa choroba płuc związana z zapaleniem skórno-mięśniowym; FVC: natężona pojemność życiowa; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; IPF: idiopatyczne włóknienie płuc; MCTD-ILD: śródmiąższowa choroba płuc związana z mieszaną chorobą tkanki łącznej; PFT: badania czynnościowe płuc; PM-ILD: śródmiąższowa choroba płuc związana z zapaleniem wielomięśniowym; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; SLE-ILD: śródmiąższowa choroba płuc związana z toczniem rumieniowatym układowym; SSc-ILD: śródmiąższowa choroba płuc związana z twardziną układową.
-
Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
-
Wijsenbeek MS, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
-
Marie I, Hatron PY, Dominique S, et al. Short-Term and Long-Term Outcomes of Interstitial Lung Disease in Polymyositis and Dermatomyositis. Arthritis Rheum. 2011;63:3439–3447.
-
Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
-
Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
-
Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
-
Wijsenbeek M, Kreuter M, Fischer A, et al. Non-IPF Progressive Fibrosing Interstitial Lung Disease (PF-ILD): The Patient Journey. Am J Respir Crit Care Med. 2018;197:A1678.
-
Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2 e71–e83.
-
Guler, S.A., Winstone, T.A., Murphy, D., et al. Does systemic sclerosis–associated interstitial lung disease burn out? Specific phenotypes of disease progression. Annals ATS. 2018;15;1427–1433.
-
Saketkoo LA, MMittoo S, Huscher D, et al. Connective tissue disease related interstitial lung diseases and idiopathic pulmonary fibrosis: provisional core sets of domains and instruments for use in clinical trials. Thorax. 2014;69(5):428–436.
-
Saketkoo LA, Scholand MB, Lammi MR, et al. Patient-reported outcome measures in systemic sclerosis–related interstitial lung disease for clinical practice and clinical trials. Scleroderma Relat Disord. 2020;5(2 Suppl):48–60.
-
Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11:175–183.
-
Morisset J, Dubé B, Garvey C, et al. The Unmet Educational Needs of Patients with Interstitial Lung Disease: Setting the Stage for Tailored Pulmonary Rehabilitation. Ann Am Thorac Soc. 2016;13:1026–1033.
-
Swigris JJ, Brown KK, Abdulqawi R, et al. Patients’ perceptions and patient-reported outcomes in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180075.
-
Hoffmann-Vold AM, Fretheim H, Halse AK, et al. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200;1258–1266.
-
Goh NS, Hoyles RK, Denton CP, et al. Short-term pulmonary function trends are predictive of mortality in interstitial lung disease associated with systemic sclerosis. Arthritis Rheumatol. 2017;69;1670–1678.
-
Walsh SLF, Sverzellati N, Devaraj A, et al. Connective tissue disease related fibrotic lung disease: high resolution computed tomographic and pulmonary function indices as prognostic determinants. Thorax. 2014;69(3):216–222.
-
Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56;249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
-
Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7);1518–1531.
-
Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
-
Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
Materiały dla pacjentów po angielsku