Skutki pSS‑ILD
Ryzyko zgonu wzrasta czterokrotnie u pacjentów z pierwotnym zespołem Sjögrena (pSS) i śródmiąższową chorobą płuc (ILD) w porównaniu z osobami bez ILD1

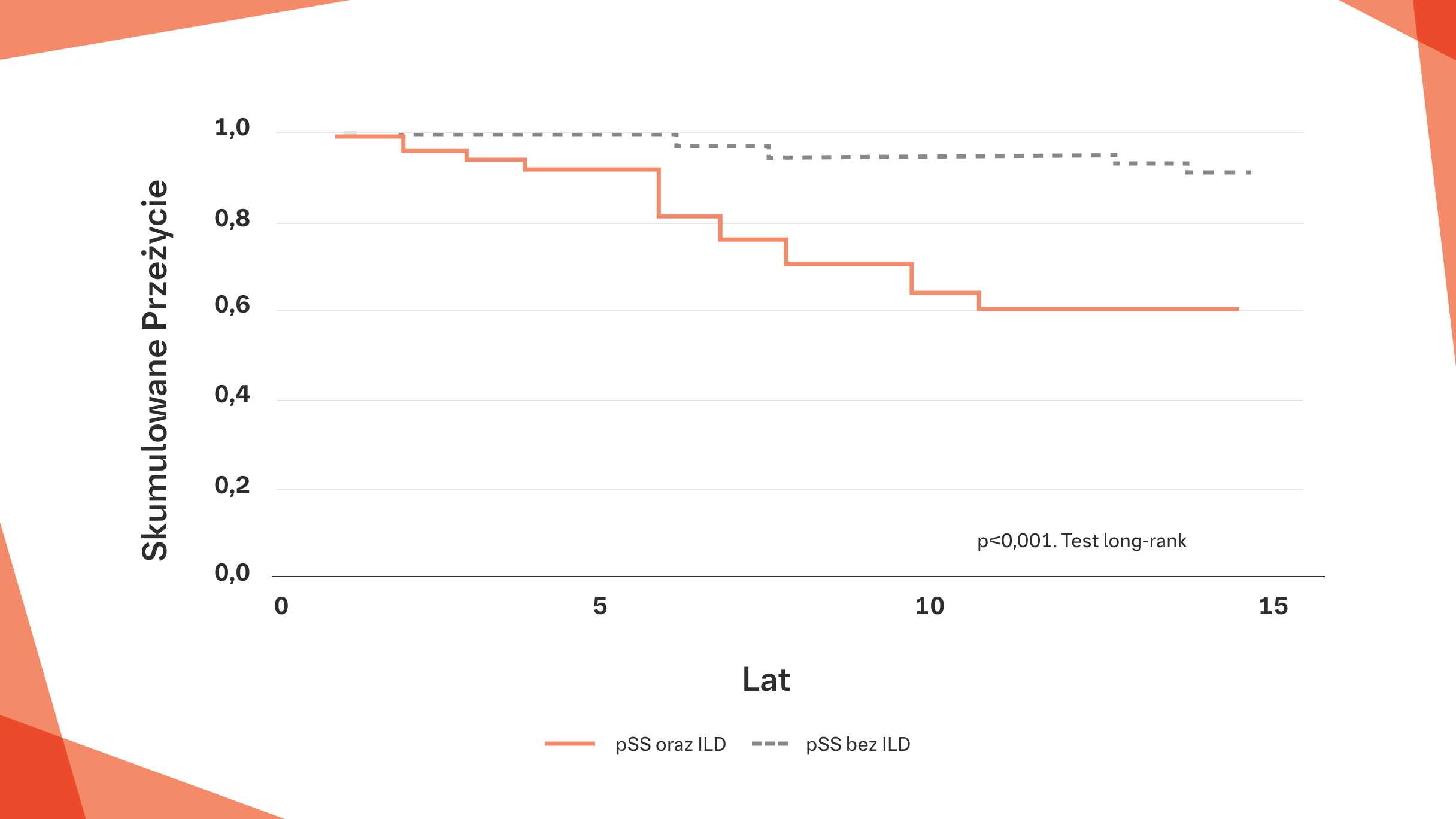
Wskaźnik przeżycia 5‑letniego u wszystkich pacjentów z pSS‑ILD wynosił 84%2
Czas przeżycia obliczono jako liczbę lat od pierwszej wizyty w celu konsultacji w związku z zaburzeniami ze strony układu oddechowego do zgonu lub punktu czasowego ocenzurowania danych. W przypadku 33 pacjentów dane ocenzurowano, jeśli żyli w dniu 30 kwietnia 2003 r. lub zmarli przed tym dniem z przyczyny niezwiązanej z badaną chorobą.
Na podstawie: Ito I, et al. Am J Respir Crit Care Med. 2005;171(6):632–638.
ZAAWANSOWANY WIEK, PŁEĆ MĘSKA I NASILENIE ZABURZEŃ CZYNNOŚCI PŁUC SĄ CZYNNIKAMI RYZYKA ZGONU U PACJENTÓW Z pSS‑ILD1,2,6
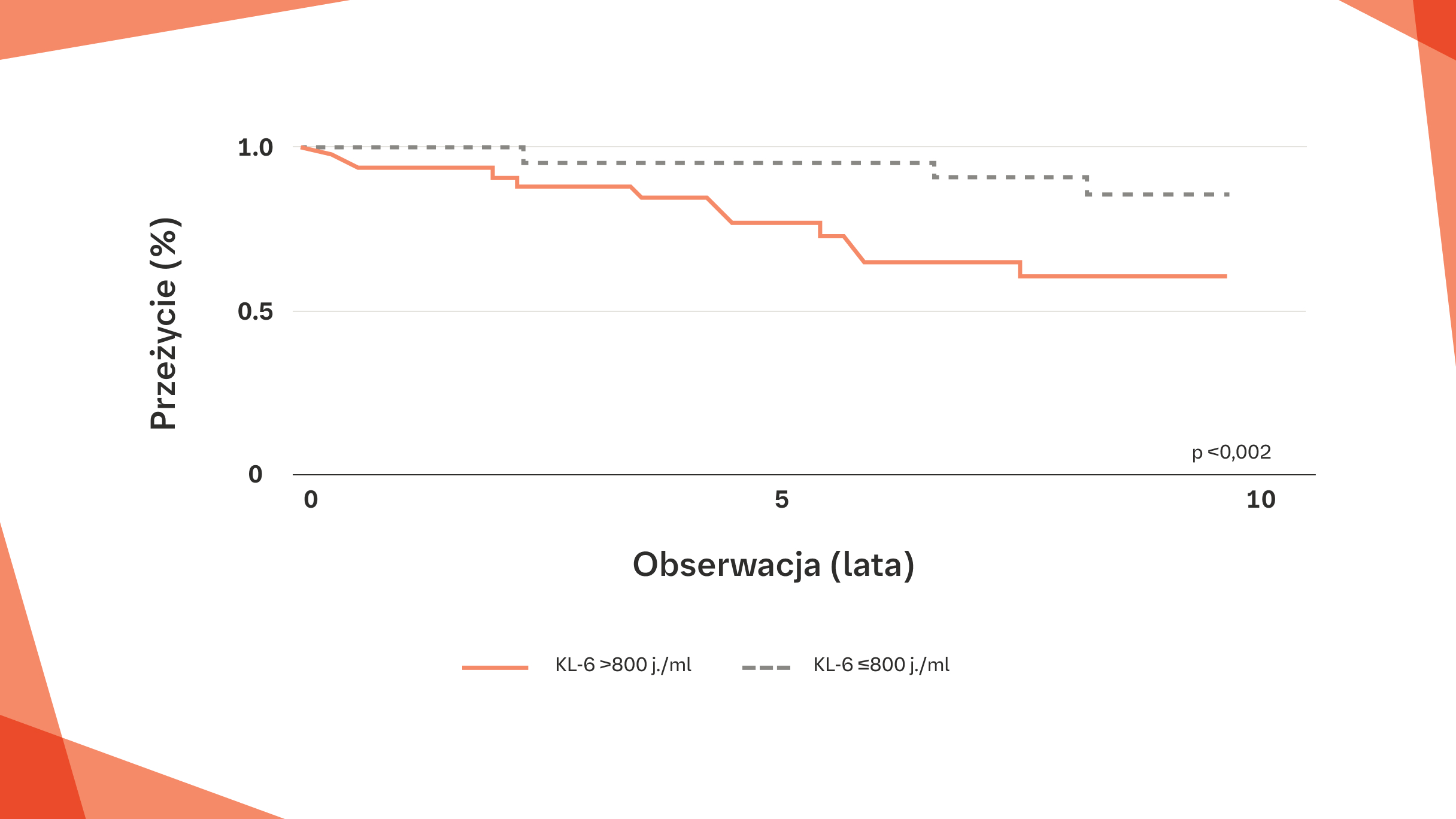
Czas przeżycia był istotnie krótszy u pacjentów z pSS‑ILD z podwyższonym poziomem KL‑6 w surowicy (>800 j./ml) w chwili pierwszego rozpoznania w porównaniu z pacjentami z poziomem KL‑6 ≤800 j./ml5
Podwyższony poziom KL-6 w surowicy (>800 j./ml) niemal trzykrotnie zwiększa ryzyko zgonu u pacjentów z pSS-ILD (HR 2,93, 95% CI: 1,04–8,10, p=0,04)5
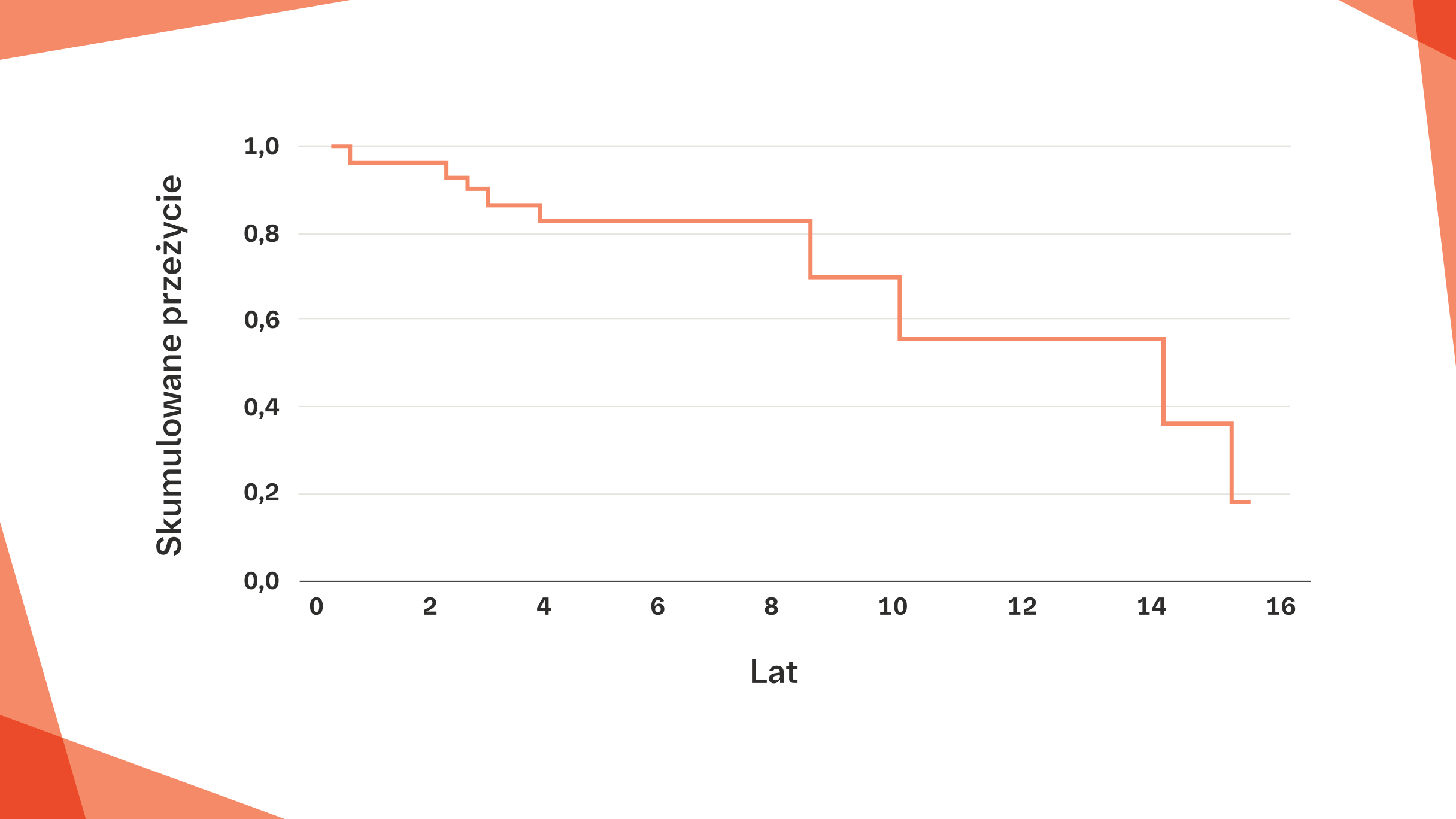
Krzywa przeżycia Kaplana-Meiera dla 99 kolejnych pacjentów z pSS-ILD zdiagnozowanych w latach 1990–2017 w japońskim badaniu retrospektywnym. Mediana wieku pacjentów wyniosła 68 lat, a 72 (73%) spośród 99 pacjentów stanowiły kobiety. Mediana czasu obserwacji wynosiła 5,97 roku.
Na podstawie: Kamiya Y, et al. Respir Med. 2019;159:105811.
U pacjentów z pSS i ciężkim zajęciem płuc (wysoki wynik oceny zajęcia płuc w badaniu HRCT, wynoszący 13–18) mediana całkowitego czasu przeżycia była krótsza niż u pacjentów z łagodnym lub umiarkowanym zajęciem płuc (wynik oceny w HRCT 0–12) (p<0,001)6
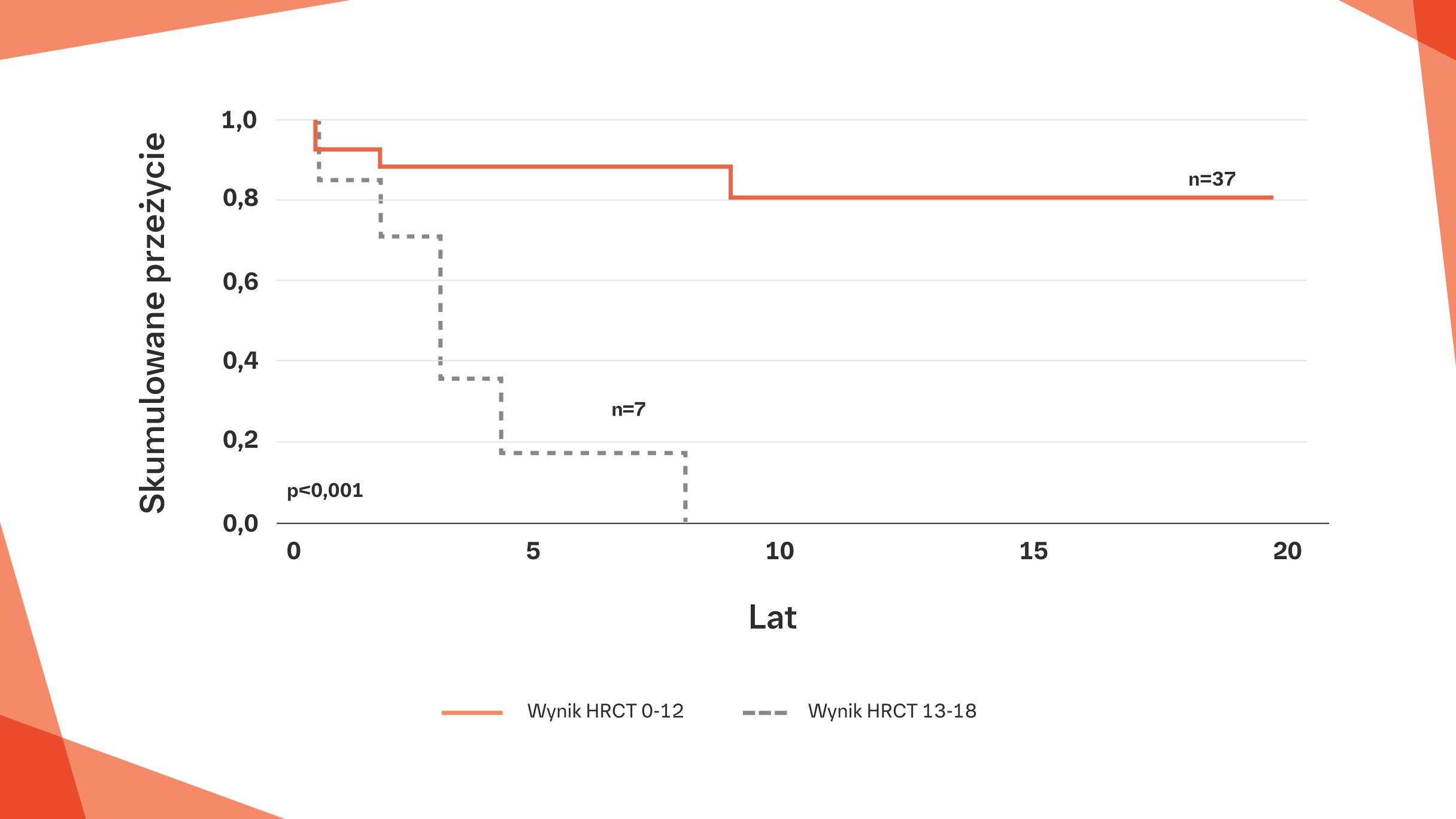
Stopień zajęcia płuc klasyfikowano na podstawie badania HRCT, przy czym wynik HRCT 0–6 określano jako łagodny, 7–12 jako umiarkowany, a 13–18 jako ciężki.
Nagłe zaostrzenie ILD w pSS‑ILD występuje rzadko, ale może prowadzić do zgonu3,5,7,8
Podczas badania obejmującego 38-miesięczną obserwację 18 pacjentów z pSS-ILD 39% pacjentów zmarło, a 17% zmarło z powodu nagłego zaostrzenia ILD7
W retrospektywnym badaniu pacjentów z patologicznie potwierdzoną pSS-ILD, 3 (włókniejące NSIP: 2; UIP: 1) z 33 pacjentów zmarło z powodu nagłego zaostrzenia ILD (mediana czasu obserwacji: 110 miesięcy)3
W japońskim badaniu retrospektywnym z udziałem 99 pacjentów z pSS-ILD, 33% zgonów (7 z 21 pacjentów) przypisano ostrym zaostrzeniom5
W jaki sposób można identyfikować, monitorować i leczyć ILD u pacjentów z pSS?

Badania przesiewowe w kierunku ILD w pSS

Rozpoznanie pSS‑ILD

Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w pSS‑ILD
Przypisy
-
*Zmiany w badaniu HRCT oceniano według metody Schurawitzkiego. Płuca podzielono na segmenty górne, środkowe i dolne, a każdemu obszarowi segmentu przypisano ocenę 0–3 według następującej skali: 0=bez zajęcia śródmiąższowego, 1=minimalny wzorzec zmian siateczkowych, 2=wyraźny wzorzec zmian siateczkowych i 3=zmiany typu „plastra miodu”. Wyniki uzyskane dla sześciu segmentów płuc dodano, aby uzyskać ogólny wynik, który wahał się od 0 (prawidłowy wynik badania) do wyniku maksymalnego wynoszącego 18 12
CI: przedział ufności; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; FEV1: natężona objętość wydechowa pierwszosekundowa; FVC: natężona pojemność życiowa; HR: współczynnik ryzyka; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; KL-6: Krebs von den Lungen-6; NSIP: nieswoiste śródmiąższowe zapalenie płuc; PaCO2: ciśnienie parcjalne dwutlenku węgla; PaO2 : ciśnienie parcjalne tlenu; PFT: badania czynnościowe płuc; pSS: pierwotny zespół Sjögrena; pSS-ILD: śródmiąższowa choroba płuc związana z pierwotnym zespołem Sjögrena; UIP: zwykłe śródmiąższowe zapalenie płuc.
-
Yazisiz V, Göçer M, Erbasan F, et al. Survival analysis of patients with Sjögren’s syndrome in Turkey: a tertiary hospital-based study. Clin Rheumatol. 2020;39(1):233–241.
-
Ito I, Nagai S, Kitaichi M, et al. Pulmonary manifestations of primary Sjögren’s syndrome: a clinical, radiologic, and pathologic study. Am J Respir Crit Care Med. 2005;171(6):632–638.
-
Enomoto Y, Takemura T, Hagiwara E, et al. Prognostic factors in interstitial lung disease associated with primary Sjögren’s syndrome: a retrospective analysis of 33 pathologically-proven cases. PLoS One. 2013;8(9):e73774.
-
Gao H, Zhang X-W, He J, et al. Prevalence, risk factors, and prognosis of interstitial lung disease in a large cohort of Chinese primary Sjögren syndrome patients: a case-control study. Medicine (Baltimore). 2018;97(24):e11003.
-
Kamiya Y, Fujisawa T, Kono M, et al. Prognostic factors for primary Sjögren’s syndrome-associated interstitial lung diseases. Respir Med. 2019;159:105811.
-
Chen M-H, Chiu H-P, Lai C-C, et al. Lung involvement in primary Sjögren’s syndrome: correlation between high-resolution computed tomography score and mortality. J Chin Med Assoc. 2014;77(2):75–82.
-
Parambil JG, Myers JL, Lindell RM, et al. Interstitial lung disease in primary Sjögren syndrome. Chest. 2006;130(5):1489–1495.
-
Suda T, Kaida Y, Nakamura Y, et al. Acute exacerbation of interstitial pneumonia associated with collagen vascular diseases. Respir Med. 2009;103(6):846–853.
-
Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
-
Guisado-Vasco P, Silva M, Duarte-Millán M A, et al. Quantitative assessment of interstitial lung disease in Sjögren’s syndrome. PLoS One. 2019;14(11):e0224772.
-
Li X, Xu B, Ma Y, et al. Clinical and laboratory profiles of primary Sjögren’s syndrome in a Chinese population: a retrospective analysis of 315 patients. Int J Rheum Dis. 2015;18(4):439–446.
-
Schurawitzki H, et al. Interstitial lung disease in progressive systemic sclerosis: high-resolution CT versus radiography. Radiology. 1990;176(3):755-9.
Materiały dla pacjentów po angielsku




