Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w pSS‑ILD
Regularne monitorowanie progresji śródmiąższowej choroby płuc związanej z pierwotnym zespołem Sjögrena (pSS-ILD) może pomóc w podejmowaniu właściwych decyzji terapeutycznych1

ZALECA SIĘ MONITOROWANIE POD KĄTEM PROGRESJI pSS‑ILD POPRZEZ WYKONYWANIE BADAŃ PFT CO 3–6 MIESIĘCY PRZEZ PIERWSZE 1–2 LATA1
Fenotyp postępującego włóknienia definiuje się jako:4-7




Wykazano, że starszy wiek w chwili rozpoznania choroby jest związany z progresją ILD u pacjentów z pSS-ILD (p=0,015)8,9*

Podwyższony OB podczas oceny wyjściowej jest istotnie związany z progresją ILD u pacjentów z pSS-ILD (p=0,030)8*

W retrospektywnym, wieloośrodkowym badaniu, u pacjentów z pSS i postępującą ILD (n=7) częściej stwierdzano zajęcie przewodu pokarmowego niż u pacjentów ze stabilną ILD/poprawą (n=12) [57,1% vs. 8,3%, p=0,038]9*

duszność wysiłkowa (NHYA II) lub PFT wykazujące restrykcję do wartości FVC w zakresie 60–80% wartości należnej lub DLCO w zakresie 40%–70% wartości należnej

duszność spoczynkowa (NHYA III, IV) lub PFT z FVC <60% wartości należnej lub DLCO <40% wartości należnej
PROGRESJA I NASILENIE ILD SĄ GŁÓWNYMI CZYNNIKAMI, KTÓRE NALEŻY BRAĆ POD UWAGĘ PRZY PODEJMOWANIU DECYZJI TERAPEUTYCZNYCH W pSS‑ILD1
Należy przeprowadzić krytyczną ocenę badania HRCT w celu określenia głównego wzorca u pacjentów z pSS-ILD, u których nie występuje odpowiedź na leczenie pierwszego rzutu lub których stan się pogarsza i należy wziąć pod uwagę różne opcje leczenia.1
Leczenie pSS-ILD należy eskalować w przypadku wystąpienia progresji ILD.1 Jeśli u pacjenta z pSS-ILD rozwinie się fenotyp postępującego włóknienia w ILD, wówczas należy natychmiast rozważyć odpowiednie leczenie.1
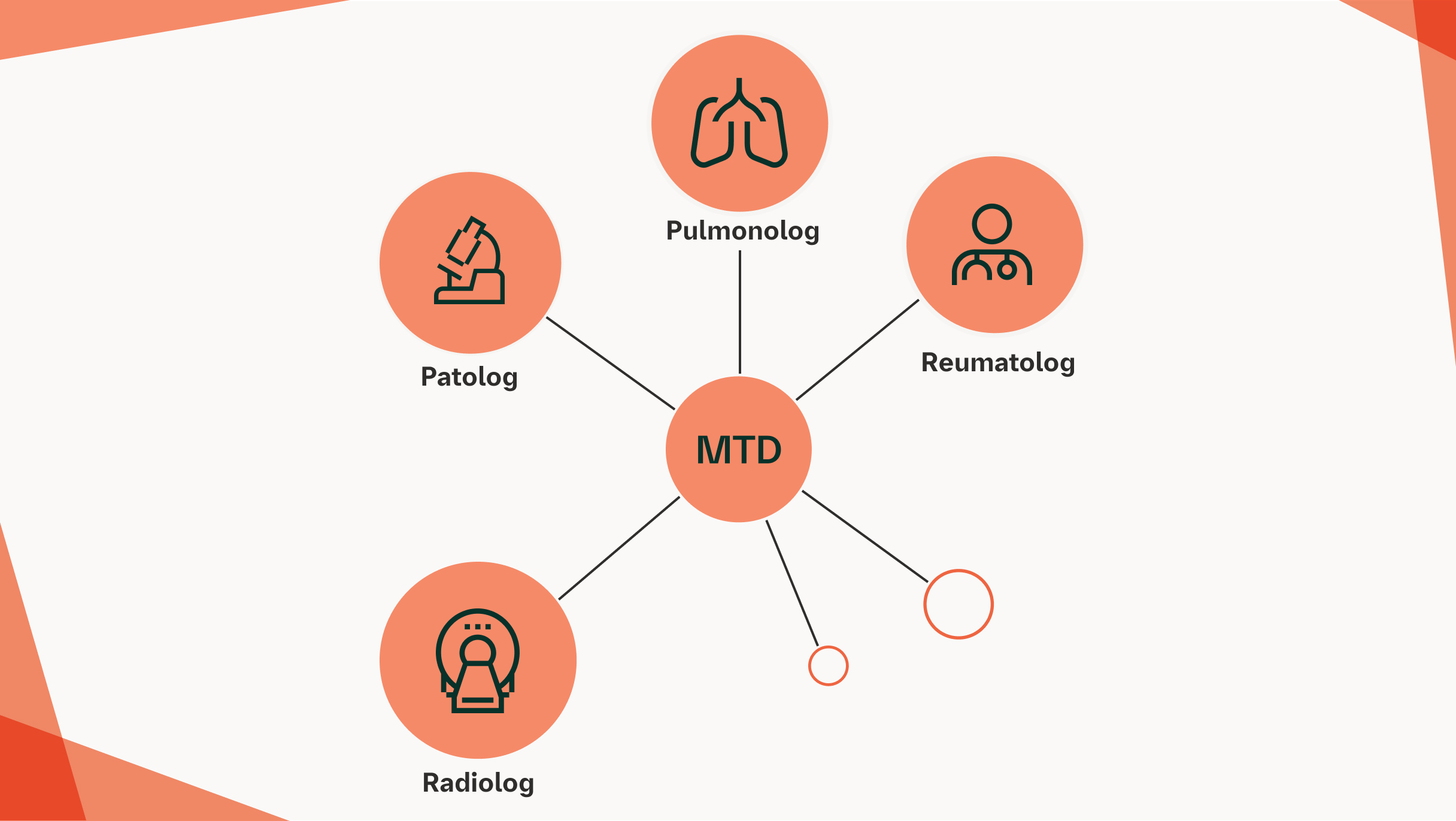
W JAKI SPOSÓB ZESPÓŁ MULTIDYSCYPLINARNY MOŻE PRZYCZYNIĆ SIĘ DO POPRAWY POSTĘPOWANIA W pSS‑ILD?
Wielodyscyplinarne postępowanie z udziałem reumatologów i specjalistów w dziedzinie chorób układu oddechowego odgrywa istotną rolę w optymalizacji opieki nad pacjentami z pSS‑ILD1,11
Jakie inne sposoby postępowania należy brać pod uwagę?
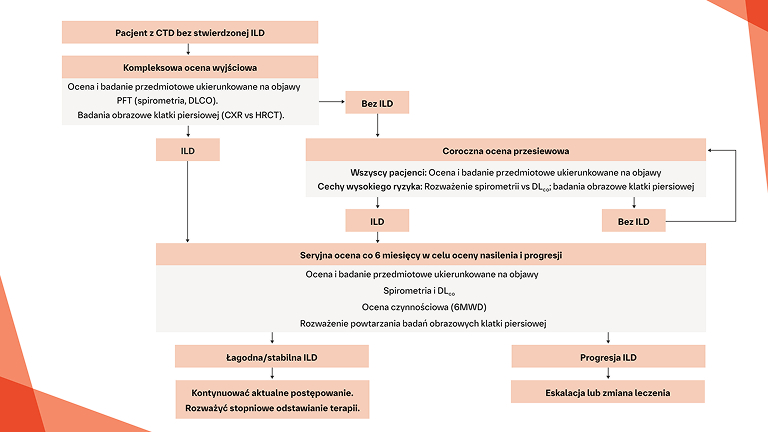
Wczesne i regularne monitorowanie pod kątem progresji ILD w CTD‑ILD
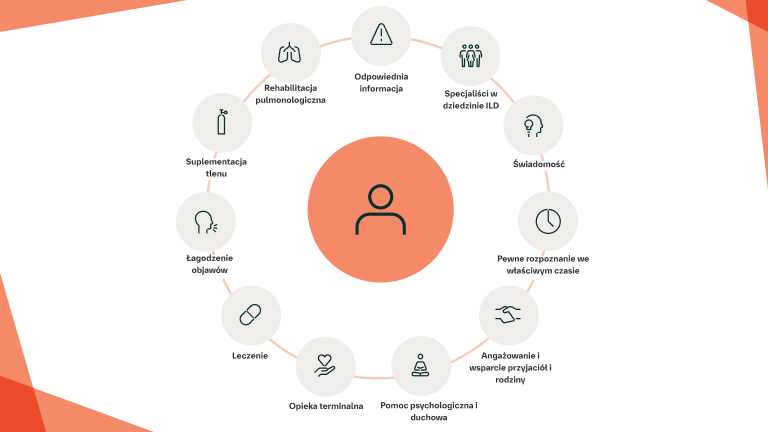
Zapewnienie opieki paliatywnej/wspomagającej

Zespoły wielodyscyplinarne
Przypisy
-
* Progresja ILD jest zdefiniowana jako spadek FVC o ≥10% i/lub DLCO o ≥15%.
CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; FVC: natężona pojemność życiowa; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; NSIP: nieswoiste śródmiąższowe zapalenie płuc; NYHA: Nowojorskie Towarzystwo Kardiologiczne; OB: opad erytrocytów; PFT: badania czynnościowe płuc; pSS: pierwotny zespół Sjögrena; pSS-ILD: śródmiąższowa choroba płuc związana z pierwotnym zespołem Sjögrena; UIP: zwykłe śródmiąższowe zapalenie płuc. -
-
Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
-
Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
-
Cottin V, Hirani NA, Hotchkin DL, et al. Presentation, diagnosis and clinical course of the spectrum of progressive fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. doi: 10.1183/16000617.0076-2018.
-
Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
-
Kolb M and Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1):57. doi: 10.1186/s12931-019-1022-1.
-
Zhang T, Yuan F, Xu L, Sun W, Liu L, Xue J. Characteristics of patients with primary Sjögren’s syndrome associated interstitial lung disease and relevant features of disease progression. Clin Rheumatol. 2020;39(5):1561–1568.
-
Roca F, Dominique S, Schmidt J, et al. Interstitial lung disease in primary Sjögren’s syndrome. Autoimmun Rev. 2017;16(1):48–54.
-
Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
-
Manfredi A, Sebastiani M, Cerri S, et al. Prevalence and characterization of non-sicca onset primary Sjögren syndrome with interstitial lung involvement. Clin Rheumatol. 2017;36(6):1261–1268.
-
Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
Materiały dla pacjentów po angielsku




