Rozpoznanie CTD‑ILD
Tomografia komputerowa wysokiej rozdzielczości (HRCT) w połączeniu z omówieniem na forum wielodyscyplinarnym może umożliwić pewne rozpoznanie śródmiąższowej choroby płuc (ILD) w chorobach tkanki łącznej (CTD)1–3

HRCT TO ZŁOTY STANDARD W KONTEKŚCIE WIARYGODNEGO ROZPOZNANIA BĄDŹ WYKLUCZENIA ILD1,2
PFT NALEŻY WYKONYWAĆ U PACJENTÓW Z NIEWYJAŚNIONYMI OBJAWAMI LUB WYNIKAMI BADANIA PRZEDMIOTOWEGO, KTÓRE MOGĄ SUGEROWAĆ ILD1,4
ILD charakteryzuje się wynikami PFT wykazującymi na restrykcyjną fizjologię płuc oraz upośledzoną DLCO2
Prawidłowy wynik PFT może wskazywać na obecność ILD, jeśli wcześniejsze pomiary wykazywały wartości wyższe od prawidłowych, co ilustruje znaczenie porównania z wcześniejszymi wynikami1
Zmniejszona DLCO jest często pierwszą fizjologiczną oznaką ILD,1 natomiast restrykcyjny defekt wentylacyjny, z proporcjonalnym zmniejszeniem FVC i TLC, jest charakterystyczny dla choroby bardziej zaawansowanej1,4
Badanie CPET może być przydatne w CTD-ILD w celu określenia, czy duszność jest spowodowana głównie przez ILD, chorobę naczyń płucnych, chorobę serca czy też ma inną etiologię5
JAK PACJENCI Z CTD ODCZUWAJĄ OBJAWY PŁUCNE?
Świadomy odbiór informacji przekazywanych przez pacjenta może pomóc w identyfikacji objawów ILD w przebiegu CTD:6
Pacjenci z ILD rzadko odnoszą się do samej czynności oddychania, ale zamiast tego ich problemy z oddychaniem mogą być sugerowane przez zgłaszanie obniżonej zdolności do wykonywania codziennych czynności lub zmiany priorytetów życiowych6
Pacjenci z ILD opisują występującą u nich zależność pomiędzy kaszlem a dusznością – gdzie kaszel pojawia się podczas czynności wymagających wdechu i kaszel nasila duszność6
Informacje przekazywane przez pacjenta mogą pomóc w odróżnieniu duszności (potrzeba oddychania podczas wykonywania określonych czynności prowadzi do trudności z oddychaniem i uczucia ucisku w klatce piersiowej) od zmęczenia6
JAK PACJENCI CZĘSTO OPISUJĄ OBJAWY PŁUCNE CTD‑ILD?
Częste określenia „duszności” lub „braku tchu" oraz nieprzyjemnych odczuć związanych z wdechami, używane przez pacjentów z CTD‑ILD6
Tradycyjne określenia, takie jak „duszność” czy „brak tchu”, pojawiały się rzadko – zamiast tego używano zwrotów przedstawionych na poniższej rycinie5

Badanie 6 wieloośrodkowych grup obejmujące 45 pacjentów z CTD-ILD (IIM-ILD (n=11), RZS-ILD (n=13), SSc-ILD (n=17) i różne inne rozpoznania CTD (n=4)).6
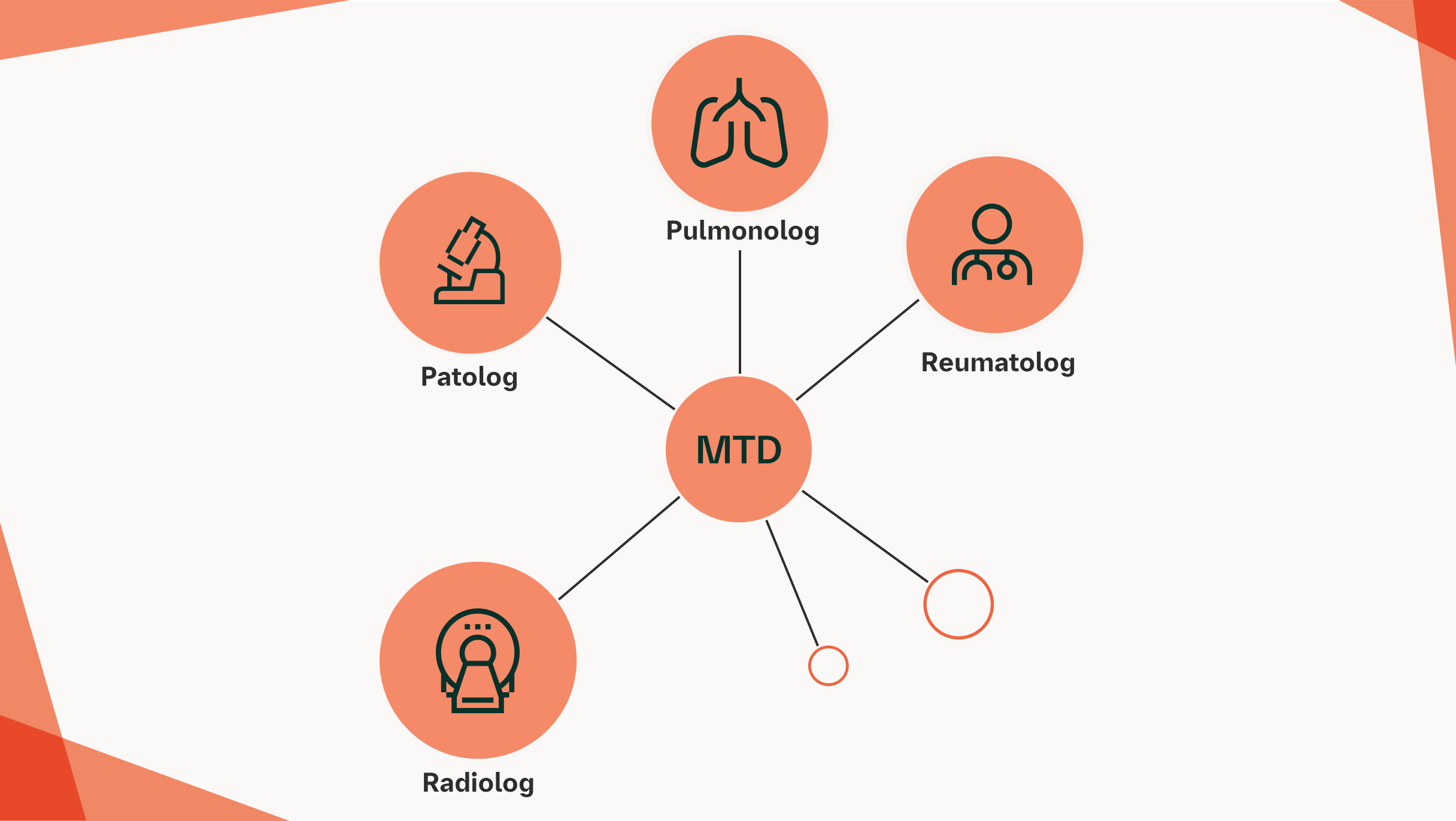
Rozpoznanie wielodyscyplinarne wiąże się z wyższym poziomem pewności diagnostycznej i lepszą zgodnością pomiędzy obserwatorami w porównaniu z sytuacją izolacji poszczególnych ról3
W przypadkach, gdy zwołanie konsylium wielodyscyplinarnego dla pacjenta z ILD jest trudne, dyskusję wielodyscyplinarną można przeprowadzić wirtualnie lub telefonicznie, aby umożliwić udział przedstawiciela każdej specjalizacji8
Więcej informacji na temat proaktywnej współpracy w zespole MDT przy rozpoznawaniu ILD



Jak należy postępować z pacjentem po ustaleniu rozpoznania CTD‑ILD?
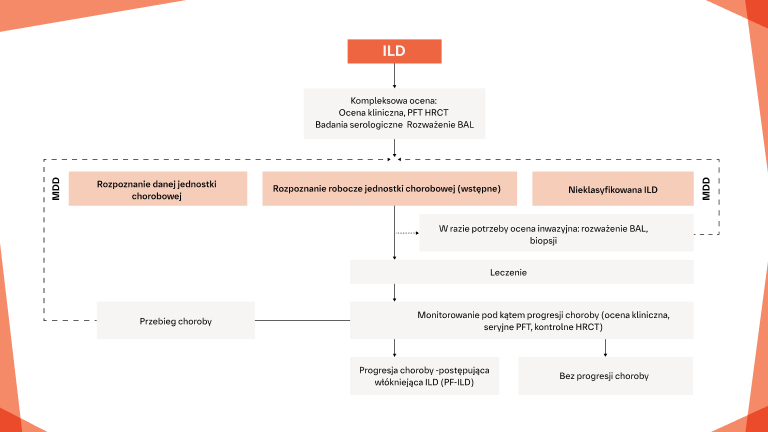
Wczesne i regularne monitorowanie pod kątem progresji ILD w CTD‑ILD
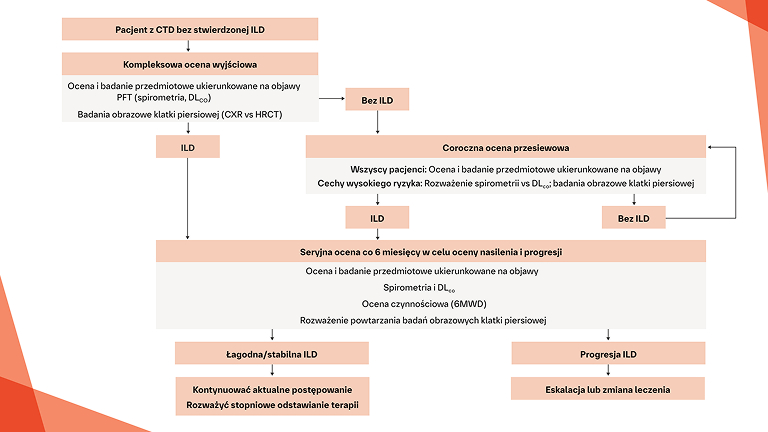
Postępowanie w postępującej włókniejącej CTD‑ILD
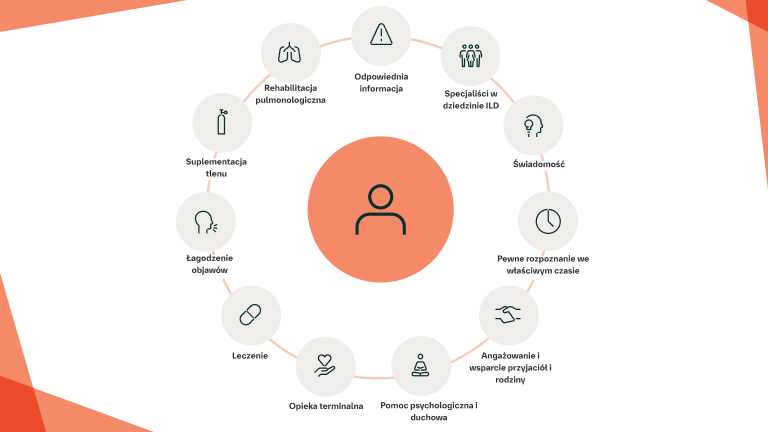
Zapewnienie opieki paliatywnej/wspomagającej
Przypisy
-
CCP: cykliczny cytrulinowany peptyd; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CXR: badanie rentgenowskie klatki piersiowej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; FVC: natężona pojemność życiowa; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; NSIP: nieswoiste śródmiąższowe zapalenie płuc; PFT: badania czynnościowe płuc; RZS: reumatoidalne zapalenie stawów; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; SSc-ILD: śródmiąższowa choroba płuc związana z twardziną układową.
-
Geerts S, Wuyts W, Langhe ED, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Walsh SLF. Multidisciplinary evaluation of interstitial lung diseases: current insights. Eur Respir Rev. 2017;26:170002.
-
Spagnolo P, Cordier JF, Cottin V. Connective tissue diseases, multimorbidity and the ageing lung. Eur Respir J. 2016;47(5):1535–1558.
-
Assayag D, Ryerson CJ. Determining respiratory impairment in connective tissue disease-associated interstitial lung disease. Rheum Dis Clin North Am. 2015;41(2):213–23.
-
Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11(2):175–183.
-
Dellaripa PF. Interstitial lung disease in the connective tissue diseases; a paradigm shift in diagnosis and treatment. Clin Immunol. 2018;186:71–73.
-
Chung JH, Goldin JG. Interpretation of HRCT Scans in the Diagnosis of IPF: Improving Communication Between Pulmonologists and Radiologists. Lung. 2018;196:561–567.
-
Chowaniec M, Skoczyńska M, Sokolik R, et al. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56, 249–254.
-
Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
-
Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
-
Luppi F, Sebastiani M, Sverzellati N, Cavazza A, Salvarani C, Manfredi A. Lung complications of Sjogren syndrome. Eur Respir Rev. 2020;29(157):200021.
-
Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
-
Manfredi A, Sebastiani M, Cerri S, et al. Prevalence and characterization of non-sicca onset primary Sjögren syndrome with interstitial lung involvement. Clin Rheumatol. 2017;36(6):1261–1268.
-
Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
Materiały dla pacjentów po angielsku




