Opisy przypadków CTD‑ILD
U pacjentów takich jak Anna i Jan występuje śródmiąższowa choroba płuc związana z chorobą tkanki łącznej (CTD-ILD), która wymaga czujności. Zapoznaj się z tymi przypadkami pacjentów z włókniejącą CTD-ILD oraz jej wpływem na pacjentów


|
OTO ANNA*
Rok temu u Anny rozpoznano ILD związane z reumatoidalnym zapaleniem stawów
Wiek: 55
Rozpoznanie podstawowe: reumatoidalne zapalenie stawów
Historia leczenia: LMPCh
Powikłania płucne: RZS-ILD z obrazem UIP w HRCT 1 rok temu
W ciągu ostatnich 6 miesięcy występujące u Anny objawy oddechowe nasiliły się, a kaszel nie pozwala jej zasnąć przez większość nocy1
Te nowe dane sugerują, że u Anny rozwinął się fenotyp postępujący
“ „To był prawdziwy szok, gdy rozpoznano u mnie RZS‑ILD. Naprawdę zadawałam sobie pytanie: „Dlaczego ja?” Zawsze byłam taka aktywna, a teraz będę musiała ponownie przemyśleć swoje życie” ”
Pacjenci z RZS‑ILD, tacy jak Anna, są narażeni na ryzyko wczesnego zgonu2,3



JAK DŁUGO MOGĄ PRZEŻYĆ PACJENCI TACY JAK ANNA?
U pacjentów z RZS‑ILD czas przeżycia jest istotnie krótszy niż u osób bez ILD3†
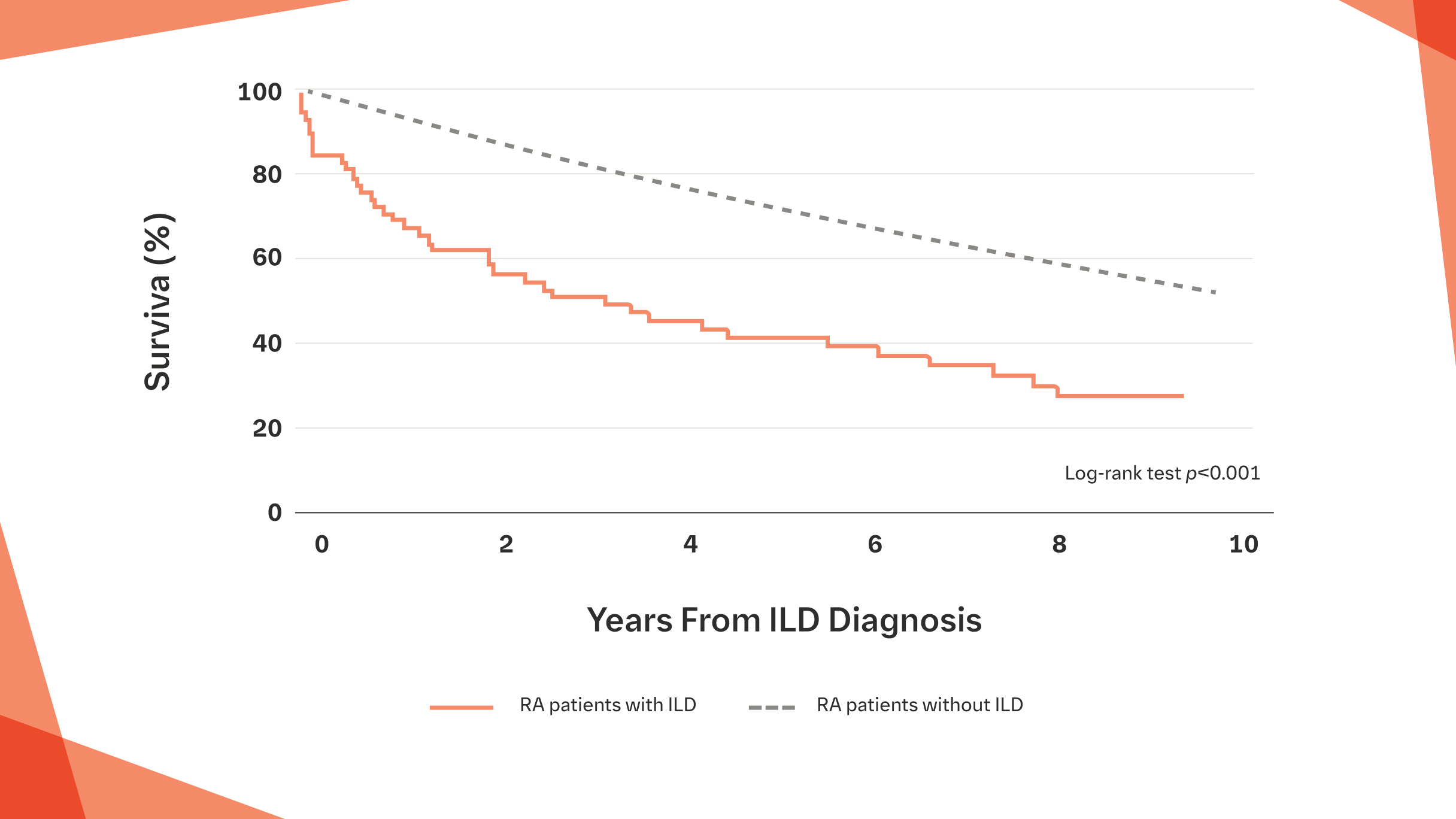
Krzywa Kaplana-Meiera przedstawiająca przeżycie od rozpoznania ILD u pacjentów z RZS oraz ILD w porównaniu z pacjentami bez ILD3
Na podstawie: Bongartz T, et al. Arthritis Rheum. 2010;62:1583-1591.
U pacjentów z RZS-ILD z UIP w badaniu HRCT czas przeżycia jest krótszy niż u pacjentów z NSIP w badaniu HRCT2
Ponadto nagłe zaostrzenie ILD stanowi poważne zdarzenie u wszystkich pacjentów z RZS-ILD5,6


|
OTO JAN*
U Jana rozpoznano ILD związaną z mieszaną chorobą tkanki łącznej trzy lata temu
Wiek: 44
Rozpoznanie podstawowe: mieszana choroba tkanki łącznej
Powikłania płucne: MCTD-ILD 3 lata temu
U Jana występowała coraz większa duszność, która zaczęła utrudniać mu wykonywanie codziennych czynności7
Te nowe dane sugerują, że u Jana rozwinął się fenotyp postępujący
“ „Posiadanie dwójki dzieci w wieku szkolnym oznacza, że powinienem biegać z nimi po różnych klubach i zajęciach, ale moja CTD‑ILD powoduje, że ledwo mam energię, aby grać w piłkę w parku z moimi dziećmi bez zadyszki” ”
JAK DŁUGO MOGĄ PRZEŻYĆ PACJENCI TACY JAK JAN?
PACJENCI Z MCTD‑ILD, TACY JAK JAN, SĄ NARAŻENI NA RYZYKO WCZESNEGO ZGONU7
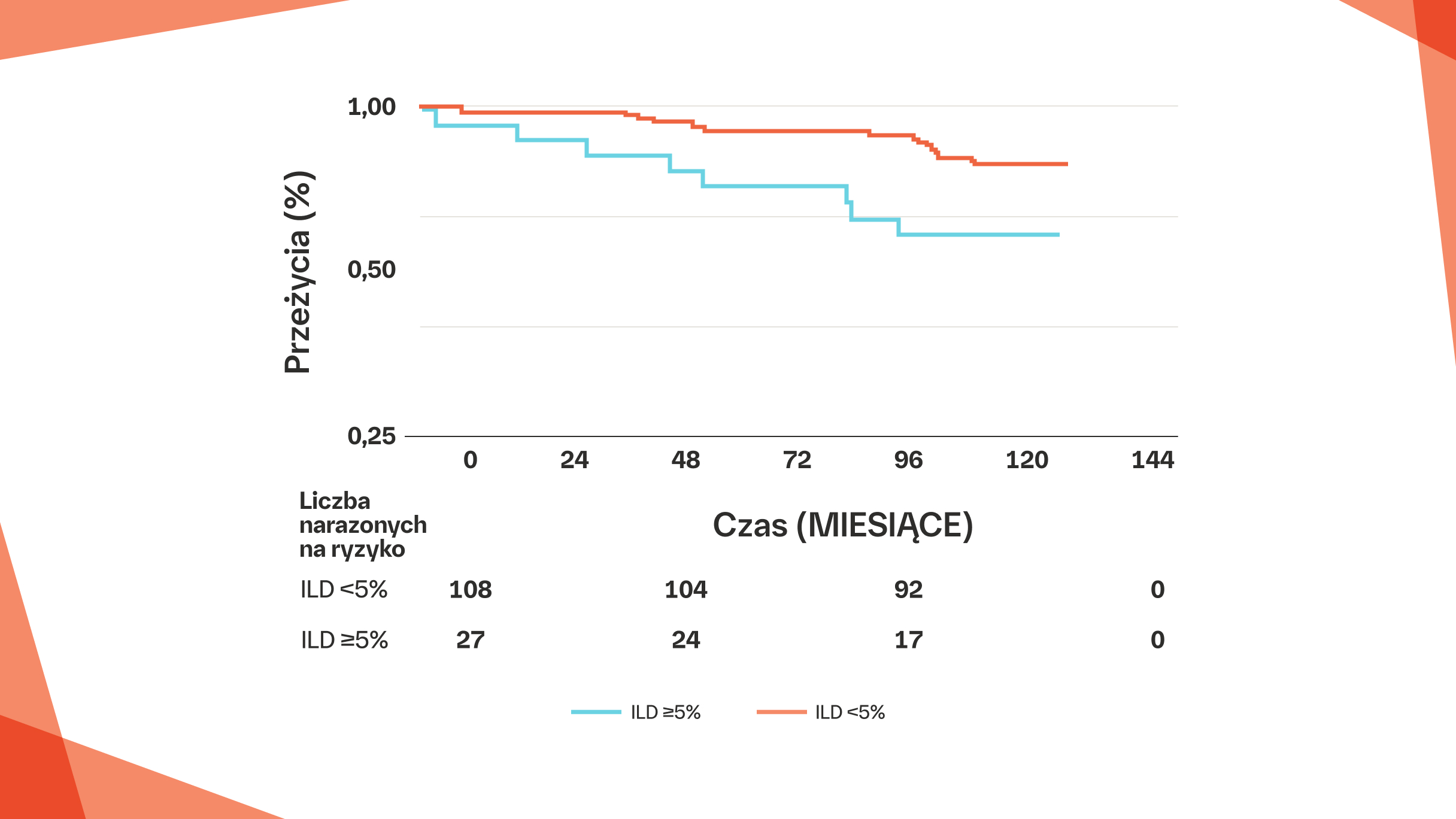
U pacjentów z MCTD‑ILD zajmującą ≥5% całkowitej objętości płuc przeżycie jest istotnie gorsze niż u pacjentów z zajęciem <5% całej objętości płuc7‡
10-letnie skumulowane przeżycie u pacjentów z MCTD oraz ILD, u których zajęte było ≥10% TLV, wynosiło 60% (95% CI: 29%, 81%)7‡
Jak zidentyfikować włókniejącą ILD możliwie jak najwcześniej u pacjentów z CTD?
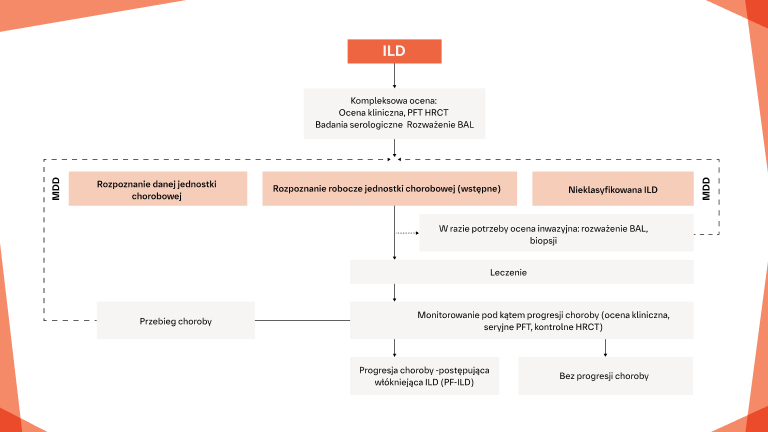
Wczesne i regularne monitorowanie pod kątem progresji ILD w CTD‑ILD
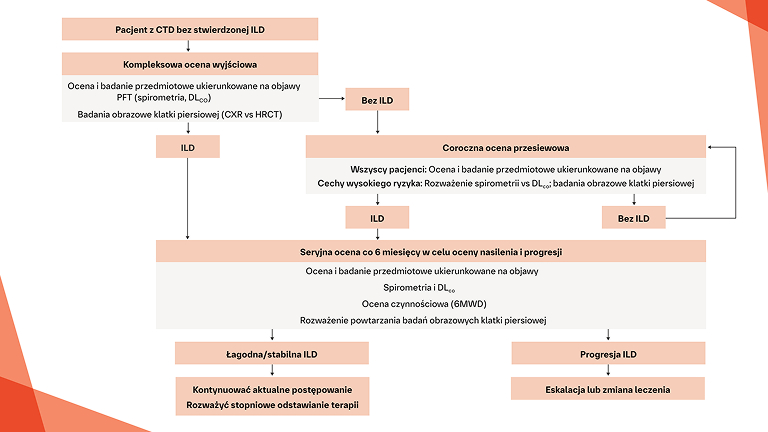
Postępowanie w postępującej włókniejącej CTD‑ILD
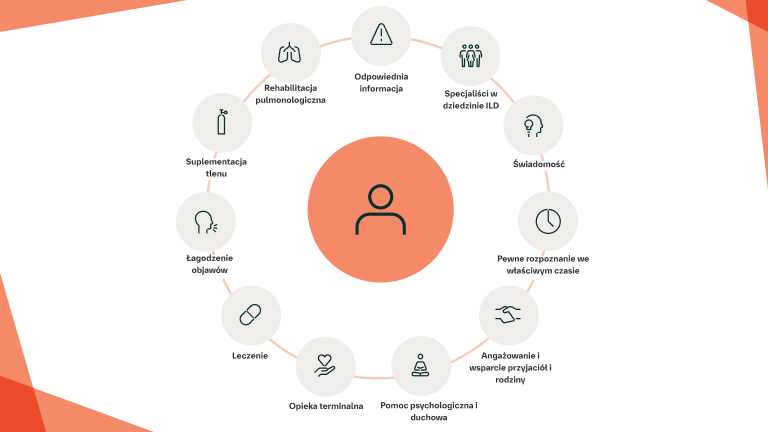
Zapewnienie opieki paliatywnej/wspomagającej
Przypisy
CI: przedział ufności; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; FVC: natężona pojemność życiowa; HR: współczynnik ryzyka; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; IPF: idiopatyczne włóknienie płuc; LMPCh: lek przeciwreumatyczny modyfikujący przebieg choroby; MCTD: mieszana choroba tkanki łącznej; MCTD-ILD: śródmiąższowa choroba płuc związana z mieszaną chorobą tkanki łącznej; RZS: reumatoidalne zapalenie stawów; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; TLV: całkowita objętość płuc; UIP: zwykłe śródmiąższowe zapalenie płuc.
*Hipotetyczny pacjent. Cytaty służą wyłącznie do celów ilustracyjnych.
† Po skorygowaniu o wiek, płeć i palenie tytoniu (HR=2,86; 95% CI: 1,98, 4,12; p<0,001).3
‡ Z długoterminowego badania obserwacyjnego pacjentów z mieszaną CTD (N=135), u których wyjściowo wykonano badanie HRCT. W badaniu tym oceniano częstość występowania, rozległość, progresję i skutki czynnościowe ILD. 10-letnie skumulowane przeżycie wynosiło 87% (95% CI: 79%, 92%) oraz 70% (95% CI: 49%, 84%) u pacjentów z MCTD i z ILD zajmującą odpowiednio <5% TLV oraz ≥5% TLV (p=0,015).
-
Iqbal K, Kelly C. Treatment of rheumatoid arthritis associated interstitial lung disease: a perspective review. Ther Adv Musculoskel Dis. 2015;7(6):247–267.
-
Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2016;47:588–596.
-
Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: A population based study. Arthritis Rheum. 2010;62(6):1583–1591.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Song JW, Lee H, Lee C, et al. Clinical Course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Dif. 2013;30:103–112.
-
Kolb M and Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20:57.
-
Reiseter S, Gunnarrson R, Aalokken TM, et al. Progression and mortality of interstitial lung disease in mixed connective tissue disease: a long-term observational nationwide cohort study. Rheumatology. 2018;57:255–262.
-
Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
-
Geerts S, Wuyts W, de Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Dif. 2017;34:326–335.
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10:728–739.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
Materiały dla pacjentów po angielsku




