Badania przesiewowe w kierunku ILD w pSS
Choć wszyscy pacjenci z pierwotnym zespołem Sjögrena (pSS) są narażeni na ryzyko rozwoju śródmiąższowej choroby płuc (ILD) i należy u nich wykonywać badania przesiewowe pod tym kątem podczas oceny wyjściowej w chwili rozpoznania pSS, metoda badań przesiewowych zależy od objawów ze strony układu oddechowego

U PACJENTÓW Z pSS, U KTÓRYCH ISTNIEJE RYZYKO WYSTĄPIENIA ILD, NALEŻY SYSTEMATYCZNIE WYKONYWAĆ BADANIA PRZESIEWOWE1,2


U PACJENTÓW Z PIERWOTNYM ZESPOŁEM SJÖGRENA NALEŻY SYSTEMATYCZNIE WYKONYWAĆ WYJŚCIOWE BADANIA PRZESIEWOWE POD KĄTEM ZAJĘCIA PŁUC, ZWŁASZCZA JEŚLI JUŻ WCZEŚNIEJ WYSTĘPOWAŁY U NICH OBJAWY PŁUCNE1,2
U pacjentów z nowym rozpoznaniem pSS, u których występuje przewlekły kaszel i/lub duszność, należy wykonać badania PFT i HRCT.1 Pacjenci z pSS są narażeni na ryzyko ILD i powinni być systematycznie poddawani badaniom przesiewowym2,6
Konsensus ekspertów z 2020 roku zdecydowanie zaleca, aby klinicyści uzyskali szczegółowy wywiad medyczny dotyczący objawów ze strony układu oddechowego u wszystkich pacjentów z pSS podczas pierwszej i każdej kolejnej wizyty1
Występowanie delikatnych, końcowowydechowych trzeszczeń typu „taśmy rzepowej” obustronnie w podstawach płuc w badaniu osłuchowym może stanowić przydatną ocenę przesiewową subklinicznej ILD u pacjentów z pSS, a ich obecność powinna skłaniać do kompleksowej oceny czynności płuc12
Sugerowany algorytm z wytycznych konsensusu dla oceny przesiewowej i identyfikacji ILD u pacjentów z pSS1

*Korzyść z wykonania wyjściowych badań PFT u bezobjawowych pacjentów z pSS w odniesieniu do wyników długoterminowych nie jest jasna. Ten brak dowodów oraz potencjalne koszty badania należy wziąć pod uwagę oraz omówić tę kwestię z poszczególnymi pacjentami przed wykonaniem przesiewowych badań PFT.
Pełne badania PFT obejmują spirometrię, DLCO, objętości płuc, najlepiej mierzone metodą pletyzmografii całego ciała.
Na podstawie: Lee AS, et al. Chest. 2020 Oct 20. doi: 10.1016/j.chest.2020.10.011.
Jak należy postępować z pacjentami z pSS‑ILD po ustaleniu rozpoznania?

Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w pSS‑ILD
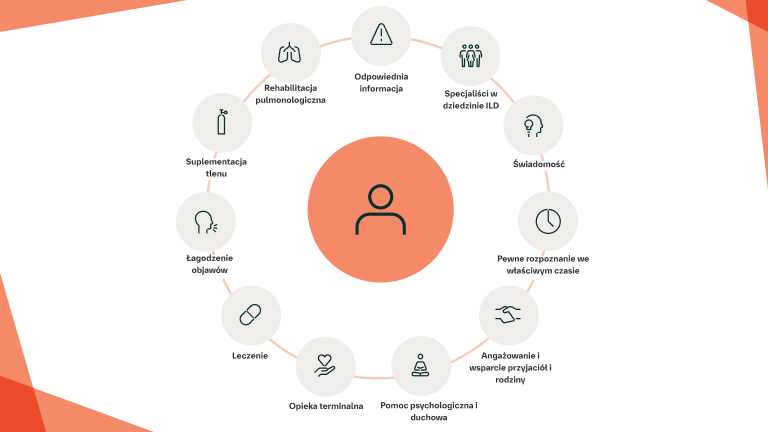
Zapewnienie opieki paliatywnej/wspomagającej

Zespoły wielodyscyplinarne
Przypisy
-
ANA: przeciwciała przeciwjądrowe; CA125: antygen nowotworowy 125; CA15-3: antygen nowotworowy 15-3; CEA: antygen karcynoembrionalny; CI: przedział ufności; CRP: białko C-reaktywne; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CXR: badanie rentgenowskie klatki piersiowej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; EULAR: Europejska Liga Przeciwreumatyczna; FVC: natężona pojemność życiowa; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; NSE: enolaza swoista dla neuronów; OB: opad erytrocytów; OR: iloraz szans; PFT: badania czynnościowe płuc; pSS: pierwotny zespół Sjögrena; pSS-ILD: śródmiąższowa choroba płuc związana z pierwotnym zespołem Sjögrena.
-
Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
-
Flament T, Bigot A, Chaigne B, Henique H, Diot E, Marchand-Adam S. Pulmonary manifestations of Sjögren’s syndrome. Eur Respir Rev. 2016;25(140):110–123.
-
Watanabe M, Naniwa T, Hara M, et al. Pulmonary manifestations in Sjögren’s syndrome: correlation analysis between chest computed tomographic findings and clinical subsets with poor prognosis in 80 patients. J Rheumatol. 2010;37(2):365–373.
-
Sambataro G, Ferro F, Orlandi M, et al. Clinical, morphological features and prognostic factors associated with interstitial lung disease in primary Sjögren’s syndrome: A systematic review from the Italian Society of Rheumatology. Autoimmun Rev. 2020;19(2):102447.
-
Ramos-Casals M, Brito-Zerón P, Seror R, et al. Characterization of systemic disease in primary Sjögren’s syndrome: EULAR-SS Task Force recommendations for articular, cutaneous, pulmonary and renal involvements. Rheumatology (Oxford). 2015;54(12):2230–2238.
-
Roca F, Dominique S, Schmidt J, et al. Interstitial lung disease in primary Sjögren’s syndrome. Autoimmun Rev. 2017;16(1):48–54.
-
Sogkas G, Hirsch S, Olsson KM, et al. Lung involvement in primary Sjögren’s syndrome—an under-diagnosed entity. Front Med (Lausanne). 2020;7:332.
-
Wang Y, Hou Z, Qiu M, Ye Q. Risk factors for primary Sjögren syndrome-associated interstitial lung disease. J Thorac Dis. 2018;10(4):2108–2117.
-
Shi L, Han X-L, Guo H-X, et al. Increased in tumor markers are associated with primary Sjögren’s syndrome-associated interstitial lung disease. Ther Adv Chronic Dis. 2020 Jul 30;11:2040622320944802. doi: 10.1177/2040622320944802.
-
Nannini C, Jebakumar AJ, Crowson CS, et al. Primary Sjögren’s syndrome 1976–2005 and associated interstitial lung disease: a population-based study of incidence and mortality. BMJ Open. 2013;3(11):e003569.
-
Guisado-Vasco P, Silva M, Duarte-Millán M A, et al. Quantitative assessment of interstitial lung disease in Sjögren’s syndrome. PLoS One. 2019;14(11):e0224772.
-
Luppi F, Sebastiani M, Sverzellati N, Cavazza A, Salvarani C, Manfredi A. Lung complications of Sjogren syndrome. Eur Respir Rev. 2020;29(157):200021.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
Materiały dla pacjentów po angielsku





