Skutki RZS‑ILD
U pacjentów z RZS śródmiąższowa choroba płuc (ILD) trzykrotnie zwiększa ryzyko zgonu i redukuje ich codzienną jakość życia1–3

ILD STANOWI GŁÓWNĄ PRZYCZYNĘ ZGONÓW U PACJENTÓW Z RZS4–6 I ODPOWIADA ZA PRAWIE 35% ZGONÓW7–10
ILD jest drugą najczęstszą, po chorobach układu krążenia, przyczyną zgonów związanych z RZS, a jej częstość występowania rośnie6,10
~35% pacjentów z RZS‑ILD prawdopodobnie umrze z powodu ILD8
ILD była najczęstszą średnią roczną podstawową przyczyną zgonu u pacjentów z RZS-ILD w populacji USA w latach 1988–20048
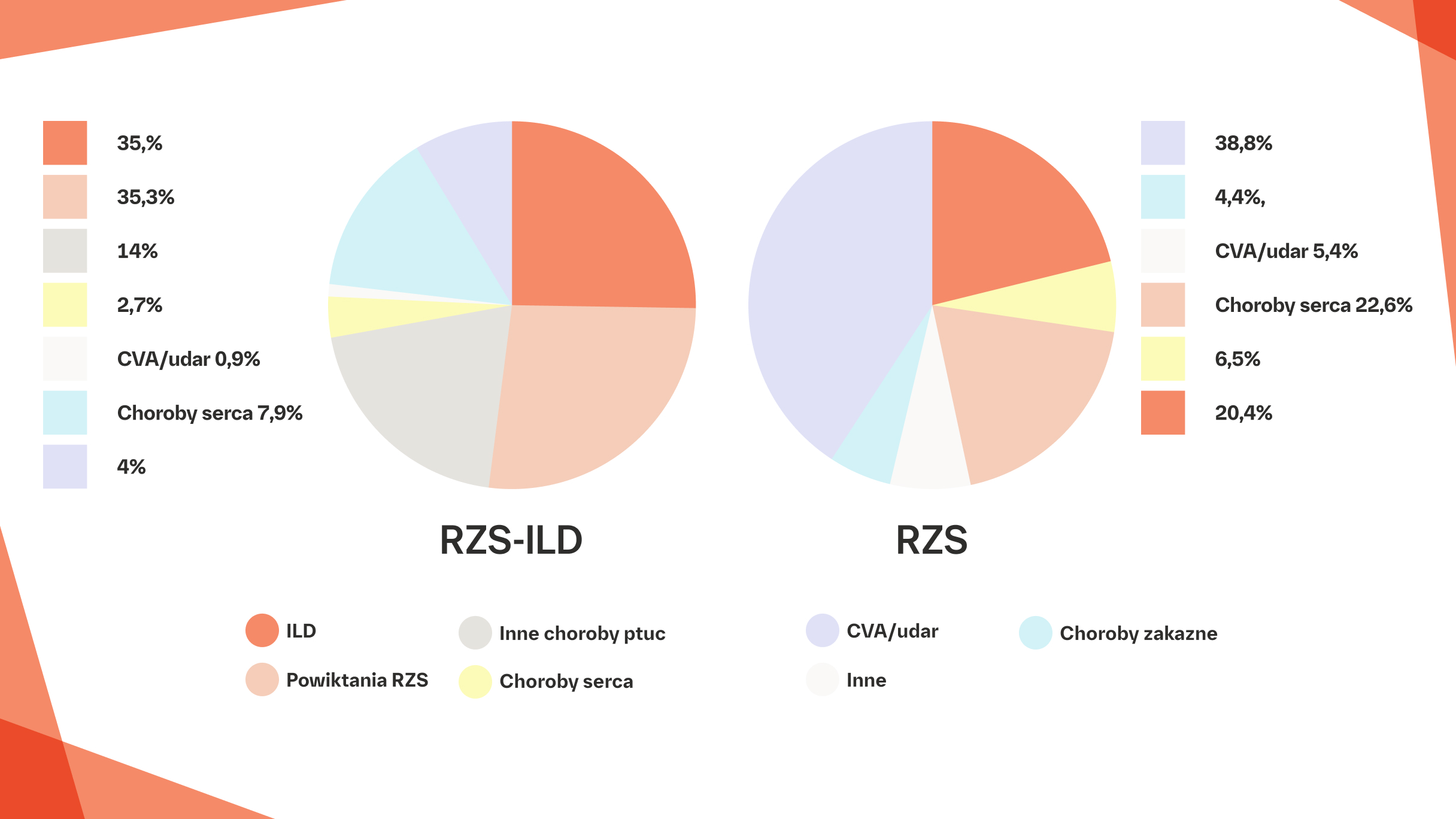
Średnia roczna podstawowa przyczyna zgonu u pacjentów z RZS-ILD (n=10 725) i z samym RZS (n=151 322) w Stanach Zjednoczonych w całym okresie badania od 1988 do 2004 roku.8
U PACJENTÓW Z RZS, ILD TRZYKROTNIE ZWIĘKSZA RYZYKO ZGONU1
U pacjentów z RZS‑ILD czas przeżycia jest istotnie krótszy niż u osób bez ILD w USA1*
W USA ryzyko zgonu u pacjentów z RZS oraz ILD wzrasta ~3-krotnie w porównaniu z pacjentami bez ILD (HR 2,86; 95% CI: 1,98, 4,12)1
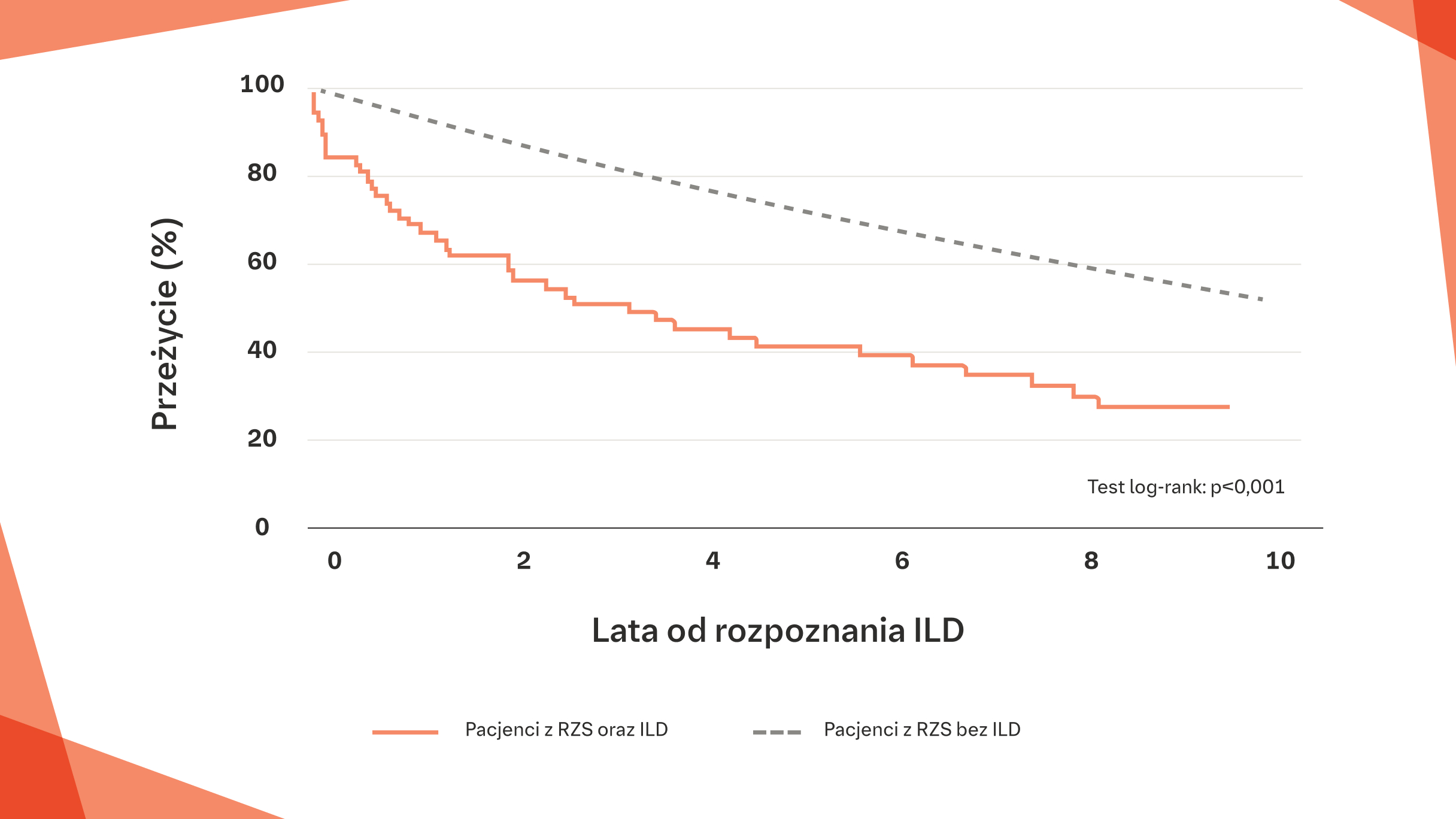
Krzywa Kaplana-Meiera przedstawiająca przeżycie od rozpoznania ILD u pacjentów z RZS oraz ILD w porównaniu z pacjentami bez ILD1
* Po skorygowaniu o wiek, płeć i palenie tytoniu (HR=2,86; 95% CI: 1,98, 4,12; p<0,001).
Na podstawie: Bongartz T, et al. Arthritis Rheum. 2010;62:1583-1591.
39% PACJENTÓW Z RZS‑ILD MOŻE UMRZEĆ W CIĄGU 5 LAT OD ROZPOZNANIA5
U pacjentów z RZS‑ILD wskaźniki śmiertelności rocznej, 5‑ i 10‑letniej są wyższe niż u pacjentów z RZS bez ILD w Europie5
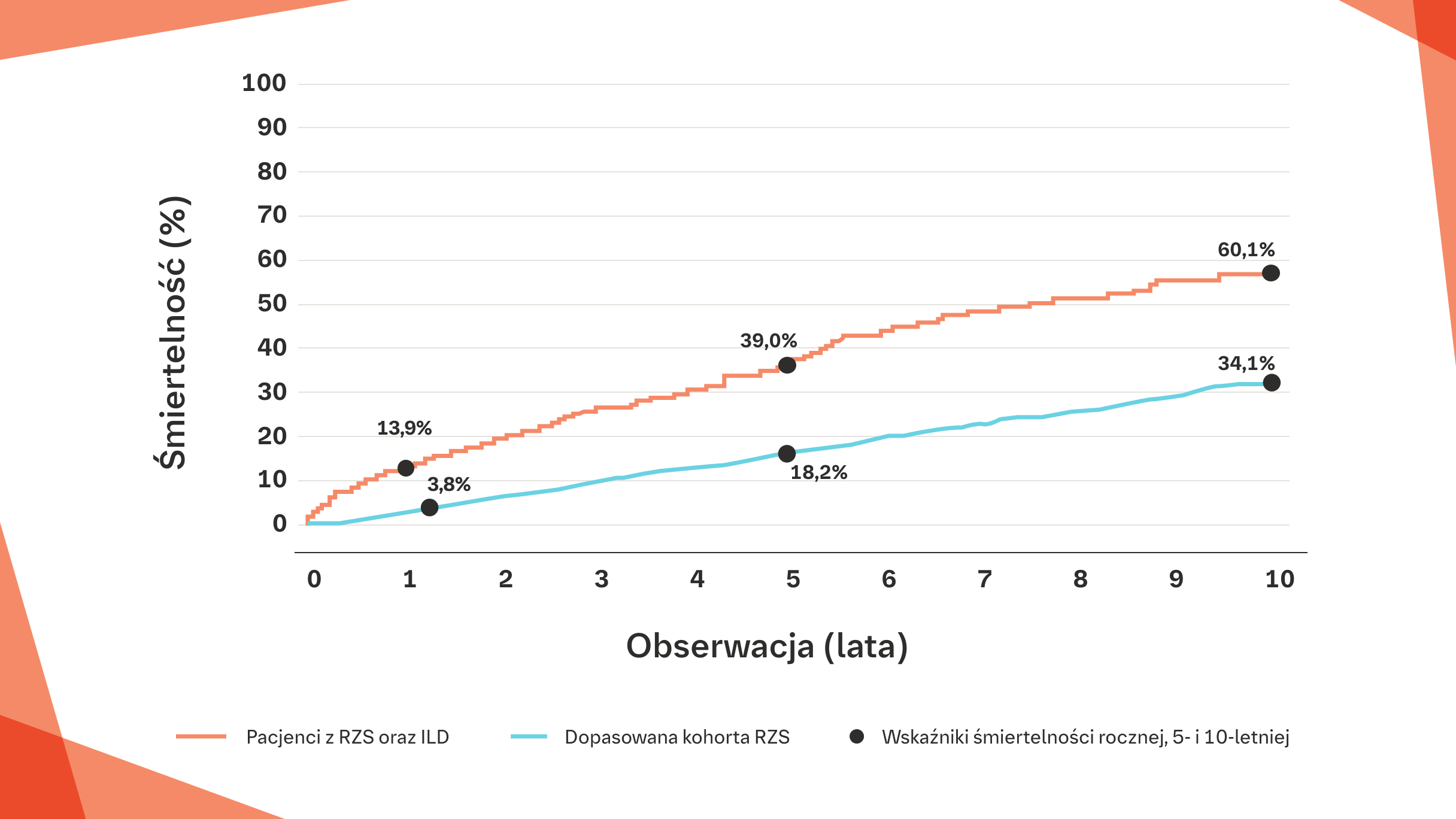
Krzywa Kaplana-Meiera przedstawiająca śmiertelność wśród pacjentów z RZS-ILD w porównaniu z pacjentami z RZS bez ILD (dobranych pod względem wieku, płci i czasu rozpoznania RZS w badaniu duńskim)5
Na podstawie: Hyidgaard C, et al. Ann Rheum Dis. 2017;76:1700-1706.
ILD U PACJENTÓW Z RZS MOŻE ZNACZĄCO SKRÓCIĆ PRZEŻYCIE O 7,3 ROKU W PORÓWNANIU Z PACJENTAMI Z RZS BEZ ILD1
Mediana czasu przeżycia pacjentów z RZS wynosi 9,9 roku w porównaniu z medianą czasu przeżycia po rozpoznaniu ILD wynoszącą 2,6 roku1,6
Pacjenci z RZS-ILD mogą przeżywać jedynie od 2,6 do 7,8 roku od momentu postawienia diagnozy1,6,11
ZAAWANSOWANY WIEK, PŁEĆ MĘSKA I NASILENIE ZABURZEŃ CZYNNOŚCI PŁUC SĄ PREDYKTORAMI WYSOKIEJ ŚMIERTELNOŚCI U PACJENTÓW Z RZS‑ILD12-15
Czynniki ryzyka zgonu w RZS‑ILD | |
| Wiek |
|
| Płeć |
|
| Wzorzec i rozległość zmian w HRCT | |
| PFT |
|
| Dotychczasowy przebieg choroby |
|
Niższy wyjściowy % wartości należnej FVC jest niezależnie związany ze zwiększonym ryzykiem zgonu w RZS-ILD (HR 1,46; p<0,0001)15
Spadek % wartości należnej FVC o 10% w stosunku do wartości wyjściowej 2,5-krotnie zwiększa ryzyko zgonu u pacjentów z RZS-ILD (HR 2,57; p<0,0001)15
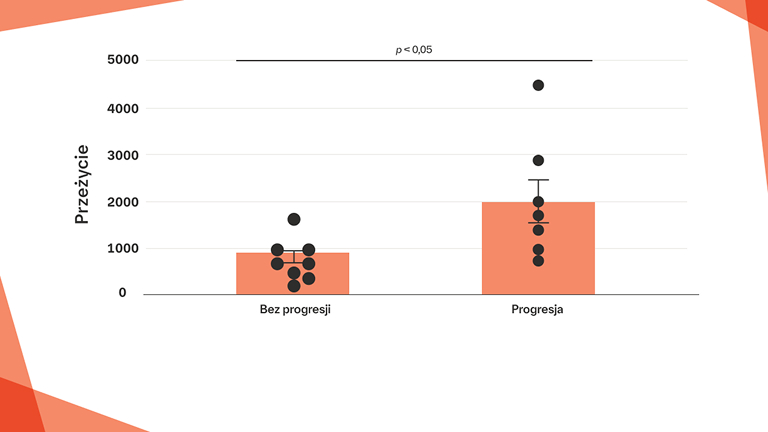
Spadek FVC o 10% i/lub spadek DLCO o >15% są związane z krótszym czasem przeżycia u pacjentów z RZS‑ILD z wzorcem UIP w badaniu HRCT20
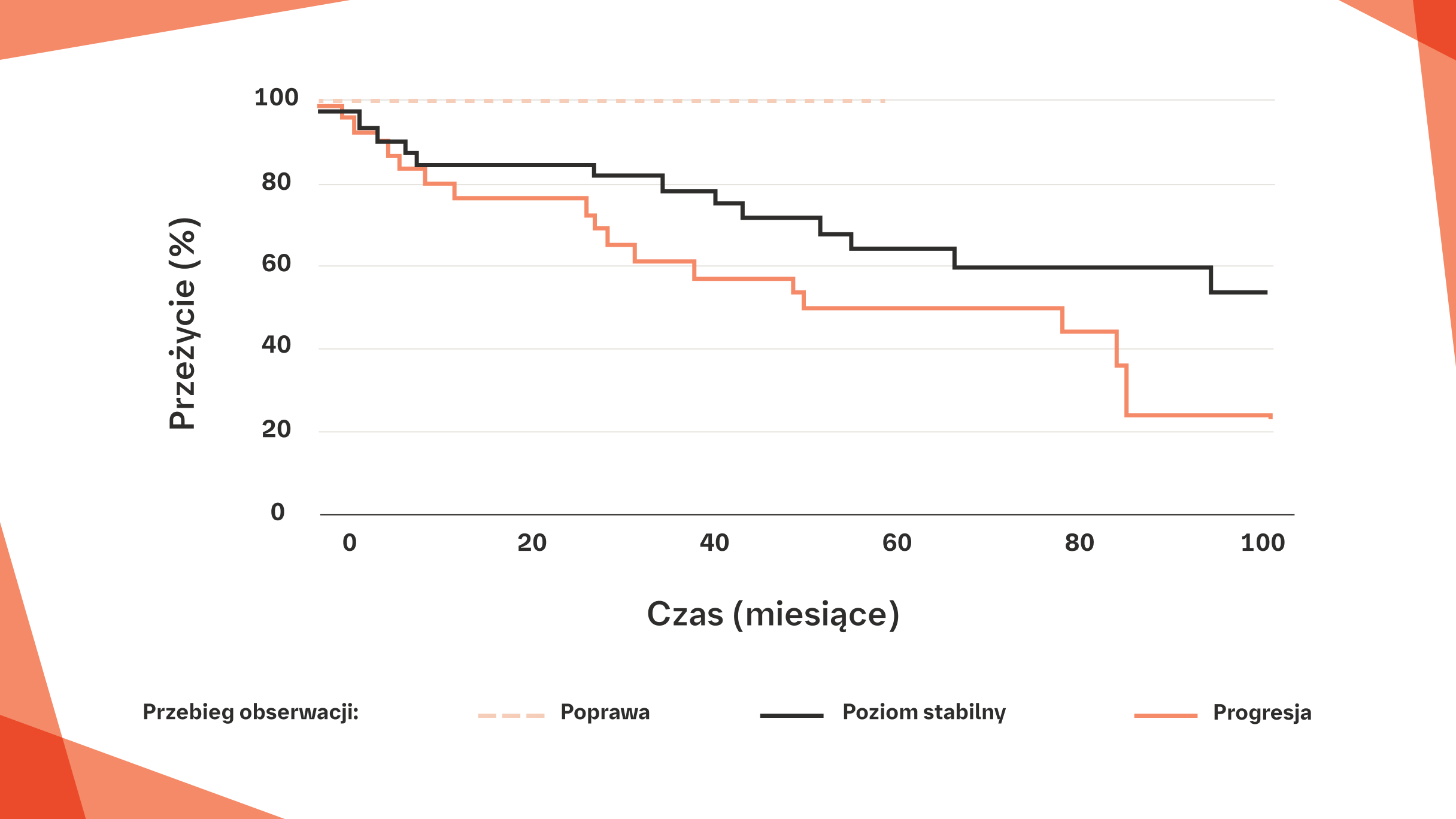
Porównanie krzywych przeżycia wśród pacjentów z RZS-ILD z obrazem UIP w badaniu HRCT o różnym przebiegu obserwacji20
Poprawa (n=5), stabilizacja (n=37), progresja (n=28).
Poprawę i progresję zdefiniowano jako zmianę FVC o >10% i/lub zmianę DLCO o >15%.
Na podstawie: Song JW, et al. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30:103–112.
U pacjentów z RZS‑ILD z radiologicznymi zmianami typu „plastra miodu” przeżycie jest gorsze niż u pacjentów bez takich zmian (p=0,024)12
U pacjentów z RZS-ILD, u których w badaniu HRCT płuc stwierdza się zmiany typu „plastra miodu”, przeżycie jest gorsze niezależnie od obrazu HRCT w chwili rozpoznania12,19
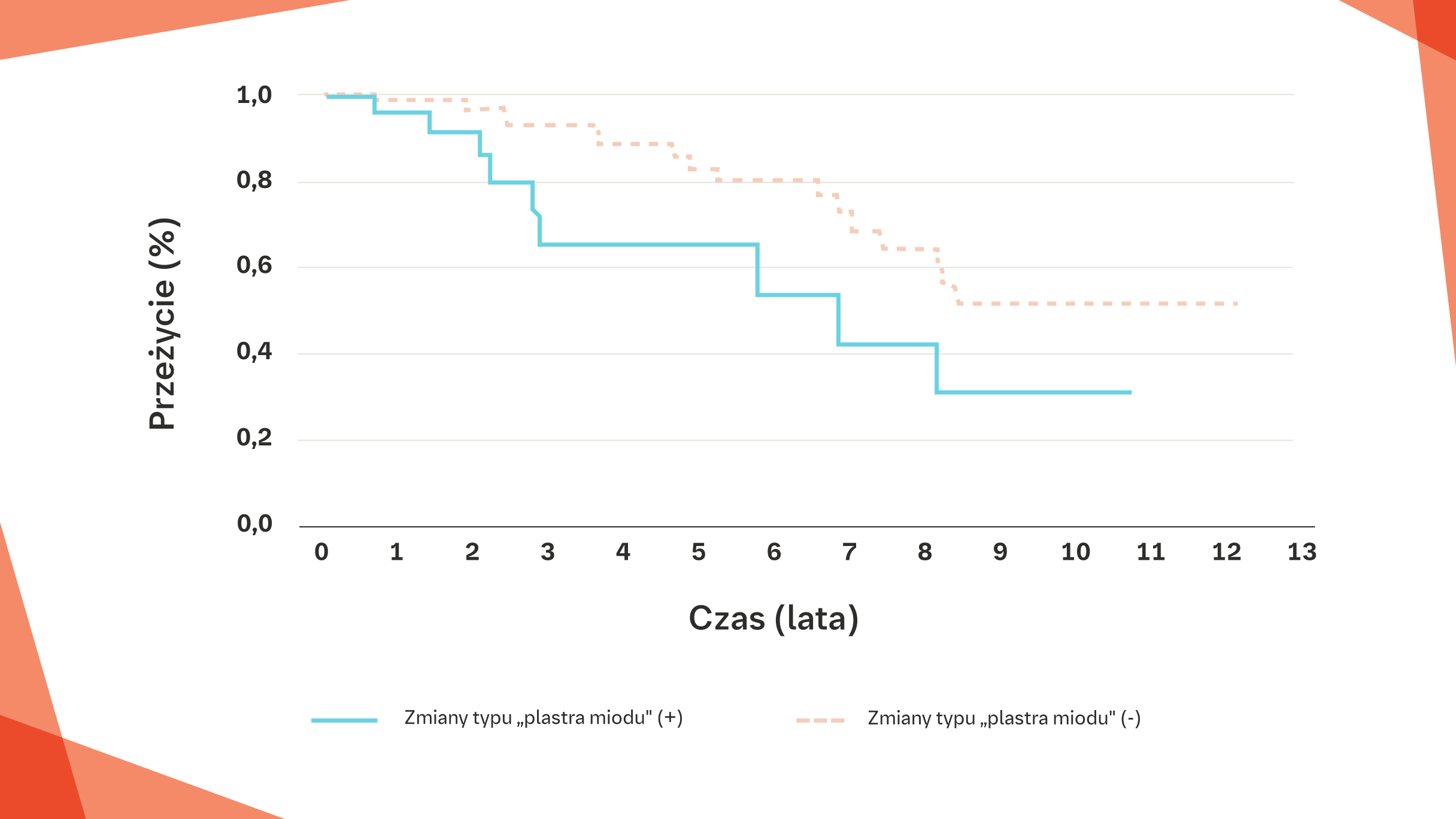
Krzywe przeżycia Kaplana-Meiera dla zgonu z dowolnej przyczyny.
Na podstawie: Yamakawa H, et al. J Thorac DIs. 20f 9:f 1:5247-5257.
NAGŁE ZAOSTRZENIE ILD CZĘSTO PROWADZI DO ZGONU U PACJENTÓW Z RZS‑ILD9,12,20,21
Nagłe zaostrzenie ILD u pacjentów z RZS‑ILD z wzorcem UIP w badaniu HRCT jest związane z bardzo złym rokowaniem20
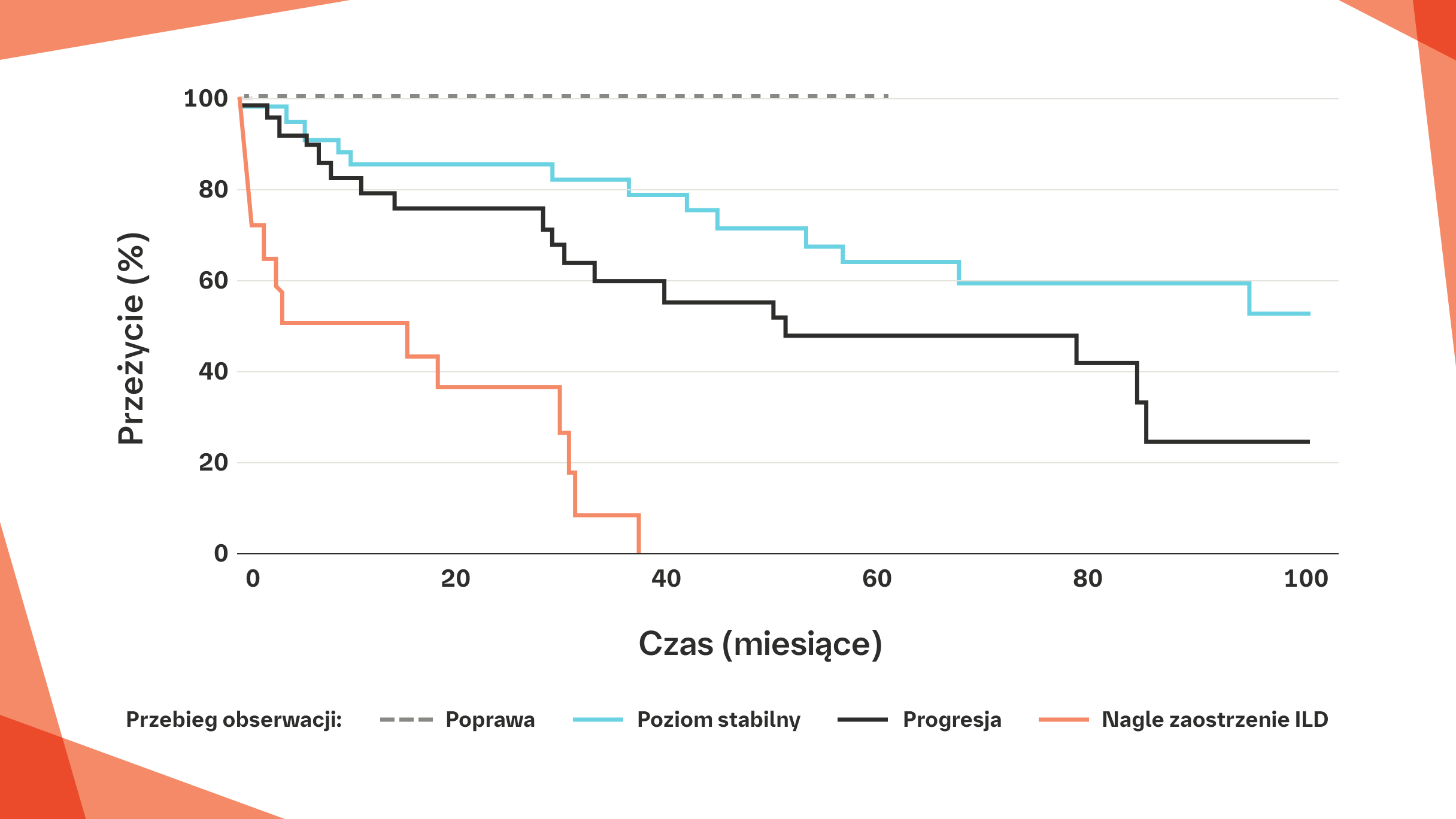
Porównanie krzywych przeżycia wśród pacjentów z RZS-ILD z obrazem UIP w badaniu HRCT o różnym przebiegu obserwacji20
Poprawa (n=5), stabilizacja (n=37), progresja (n=28), nagłe zaostrzenie ILD (n=14).
Poprawę i progresję zdefiniowano jako zmianę FVC o >10% i/lub zmianę DLCO o >15%.
Na podstawie: Song JW. et al Sarcoidosis Vasc Diffuse Lung Dis. 2013;30:103-112.
Nagłe zaostrzenie ILD często występuje jako pierwsza manifestacja RZS-ILD20 i jest związane z wysokim ryzykiem zgonu w ciągu 30 dni od rozpoznania ILD, w niektórych przypadkach jest to nagłe zaostrzenie wcześniej nierozpoznanej ILD:5


NASILENIE DUSZNOŚCI REDUKUJE CODZIENNĄ JAKOŚĆ ŻYCIA PACJENTÓW Z RZS‑ILD2,3
Stwierdzono, że nasilenie zmęczenia i duszności było najsilniej powiązane z pogorszeniem zdrowia fizycznego u pacjentów z RZS-ILD3
Nasilenie kaszlu, zmęczenia i duszności okazały się najsilniejszymi predyktorami pogorszenia zdrowia psychicznego u pacjentów z RZS-ILD3
ILD może wpływać na codzienne życie pacjentów z RZS3


Duszność istotnie wpływa na codzienne funkcjonowanie i globalne samopoczucie* u pacjentów z CTD-ILD, w tym RZS-ILD.2 Pogarszająca się desaturacja krwi tlenem może wymagać zastosowania dodatkowej tlenoterapii u pacjentów z ILD.10 Pacjenci z ILD wymagający dodatkowej tlenoterapii kojarzą ją z obawą przed uzależnieniem, ingerencją w styl życia oraz ograniczeniami fizycznymi.22
W jaki sposób można identyfikować, monitorować i leczyć ILD u pacjentów z RZS?
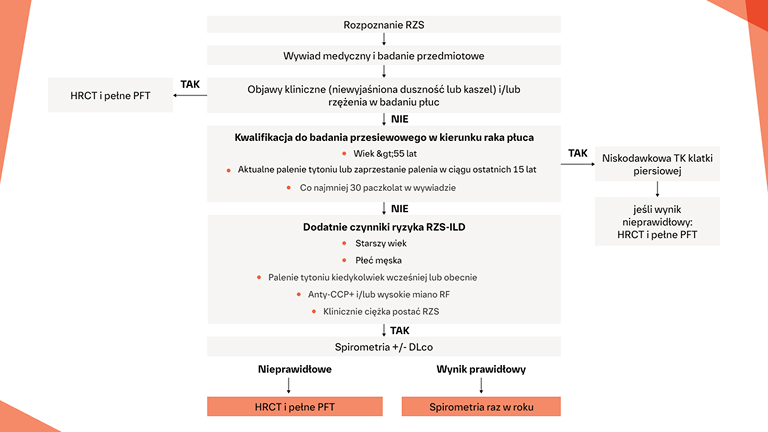
Badania przesiewowe
w kierunku ILD w RZS
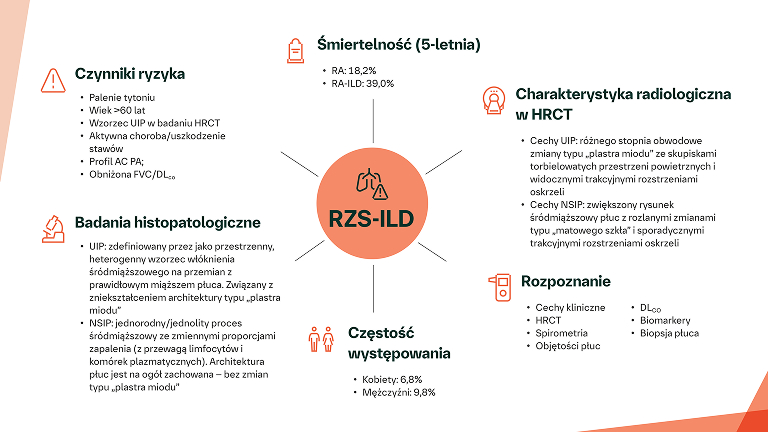
Diagnostyka RZS‑ILD
Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w RZS‑ILD
Przypisy
-
* Oceniana przy użyciu kwestionariusza MDHAQ.2
CCP: cykliczny cytrulinowany peptyd; CI: przedział ufności; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CVA: incydent naczyniowo-mózgowy; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; HR: współczynnik ryzyka; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; MDHAQ: kwestionariusz wielowymiarowej oceny stanu zdrowia; NSIP: nieswoiste śródmiąższowe zapalenie płuc; PFT: badania czynnościowe płuc; RZS: reumatoidalne zapalenie stawów; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; TLC: całkowita pojemność płuc; UIP: zwykłe śródmiąższowe zapalenie płuc; USA: Stany Zjednoczone.
-
Bongartz T, Nannini C, Medina-Velasquez YF, et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583–1591.
-
Swigris JJ, Yorke J, Sprunger DB, et al. Assessing dyspnea and its impact on patients with connective tissue disease-related interstitial lung disease. Respir Med. 2010;104(9):1350–1355.
-
Natalini JG, Swigris JJ, Moriset J, et al. Understanding the determinants of health related quality of life in rheumatoid arthritis-associated interstitial lung disease. Respir Med. 2017;127:1–6.
-
Young A, Koduri G, Batley M, et al. Mortality in rheumatoid arthritis. Increased in the early course of disease, in ischaemic heart disease and in pulmonary fibrosis. Rheumatology (Oxford). 2007;46(2):350–357.
-
Hyldgaard C, Hilberg O, Pedersen AB, et al. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700–1706.
-
Raimundo K, Solomon JJ, Olson AL, et al. Rheumatoid arthritis – interstitial lung disease in the United States: prevalence, incidence, and healthcare costs and mortality. J Rheumatol. 2019;46(4):360–369.
-
Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
-
Olson AL, Swigris JJ, Sprunger DB, et al. Rheumatoid arthritis-interstitial lung disease associated mortality. Am J Respir Crit Care Med. 2011;183(3):372-378.
-
Hyldgaard C, Ellingsen T, Hilberg O, et al. Rheumatoid arthritis-associated interstitial lung disease: clinical characteristics and predictors of mortality. Respiration. 2019;98(5):455–460.
-
Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Kelly CA, Saravanan V, Nisar M, et al. Rheumatoid arthritis-related interstitial lung disease: associations, prognostic factors and physiological and radiological characteristics – a large multicentre UK study. Rheumatology (Oxford). 2014;53(9):1676–1682.
-
Yamakawa H, Sato S, Tsumiyama E, et al. Predictive factors of mortality in rheumatoid arthritis-associated interstitial lung disease analysed by modified HRCT classification of idiopathic pulmonary fibrosis according to the 2018 ATS/ERS/JRS/ALAT criteria. J Thorac Dis. 2019;11(12):5247–5257.
-
Koduri G, Norton S, Young A, et al. Interstitial lung disease has a poor prognosis in rheumatoid arthritis: results from an inception cohort. Rheumatology (Oxford). 2010; 49(8):1483–1489.
-
Assayag D, Lubin M, Lee JS, King TE, Collard HR, Ryerson CJ. Predictors of mortality in rheumatoid arthritis-related interstitial lung disease. Respirology. 2014;19(4):493–500.
-
Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2016;47(2):588–596.
-
Kim EJ, Elicker BM, Maldonado F, et al. Usual interstitial pneumonia in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2010;35(6):1322–1328.
-
Singh N, Varghese J, England BR, et al. Impact of the pattern of interstitial lung disease on mortality in rheumatoid arthritis: A systematic literature review and meta-analysis. Semin Arthritis Rheum. 2019;49(3):358–365.
-
Tsuchiya Y, Takayanagi N, Sugiura H, et al. Lung diseases directly associated with rheumatoid arthritis and their relationship to outcome. Eur Respir J. 2011;37(6):1411–1417.
-
Yamakawa H, Sato S, Nishizawa T, et al. Impact of radiological honeycombing in rheumatoid arthritis-associated interstitial lung disease. BMC Pulm Med. 2020;20(1):25.
-
Song JW, Lee HK, Lee CK, et al. Clinical course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30(2):103–112.
-
Hozumi H, Nakamura Y, Johkoh T, et al. Acute exacerbation in rheumatoid arthritis associated interstitial lung disease: a retrospective case control study. BMJ Open. 2013;13(9): e003132. doi: 10.1136/bmjopen-2013-003132.
-
Khor YH, Goh NSL, McDonald CF, Holland AE. Oxygen therapy for interstitial lung disease. A mismatch between patient expectations and experiences. Ann Am Thorac Soc. 2017;14(6):888–895.
-
Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
Materiały dla pacjentów po angielsku




