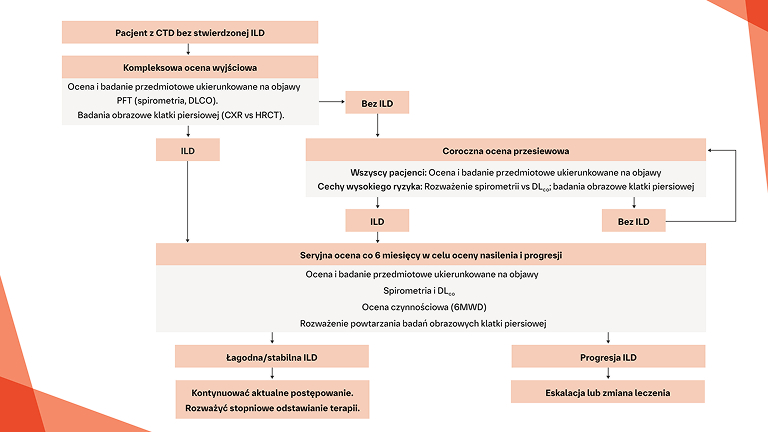
Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w RZS‑ILD
Regularne monitorowanie progresji śródmiąższowej choroby płuc związanej z reumatoidalnym zapaleniem stawów (RZS-ILD) może pomóc w podejmowaniu właściwych decyzji terapeutycznych1,2

MONITOROWANIE POD KĄTEM PROGRESJI RZS‑ILD POPRZEZ WYKONYWANIE BADAŃ PFT JEST ZALECANE W ODSTĘPACH CO 3–6 MIESIĘCY, A NASTĘPNIE CO 6–12 MIESIĘCY, JEŻELI STAN PACJENTA JEST STABILNY1
Fenotyp postępującego włóknienia definiuje się jako:5-8



Czynniki ryzyka progresji ILD w RZS‑ILD | |
| HRCT | |
| PFT | |
| Biomarkery serologiczne |
|
HRCT
Nieprawidłowości śródmiąższowe w płucach występują u 20%–60% pacjentów z RZS i wykazano, że w 57% przypadków wykazują progresję radiologiczną w okresie 1,5 roku.10,15
U pacjentów z RZS-ILD i progresją w badaniu HRCT mediana wyjściowego zajęcia płuc w formie ILA/ILD była istotnie wyższą (p=0,001)10
Wzorzec UIP w badaniu HRCT jest czynnikiem ryzyka gorszego rokowania w RZS-ILD, ale pacjenci z innymi wzorcami w HRCT również mogą wykazywać progresję, co wykazano w badaniu Mayo Clinic11
Sprawdź, jak wykorzystywać badanie HRCT w praktyce klinicznej
Odsetek pacjentów, u których nastąpiła progresja do FVC <50% wartości należnej w zależności od czasu, jaki upłynął od rozpoznania ILD11
W badaniu Mayo Clinic nie zaobserwowano różnicy pod względem progresji do FVC <50% pomiędzy pacjentami z wzorcami UIP i NSIP11
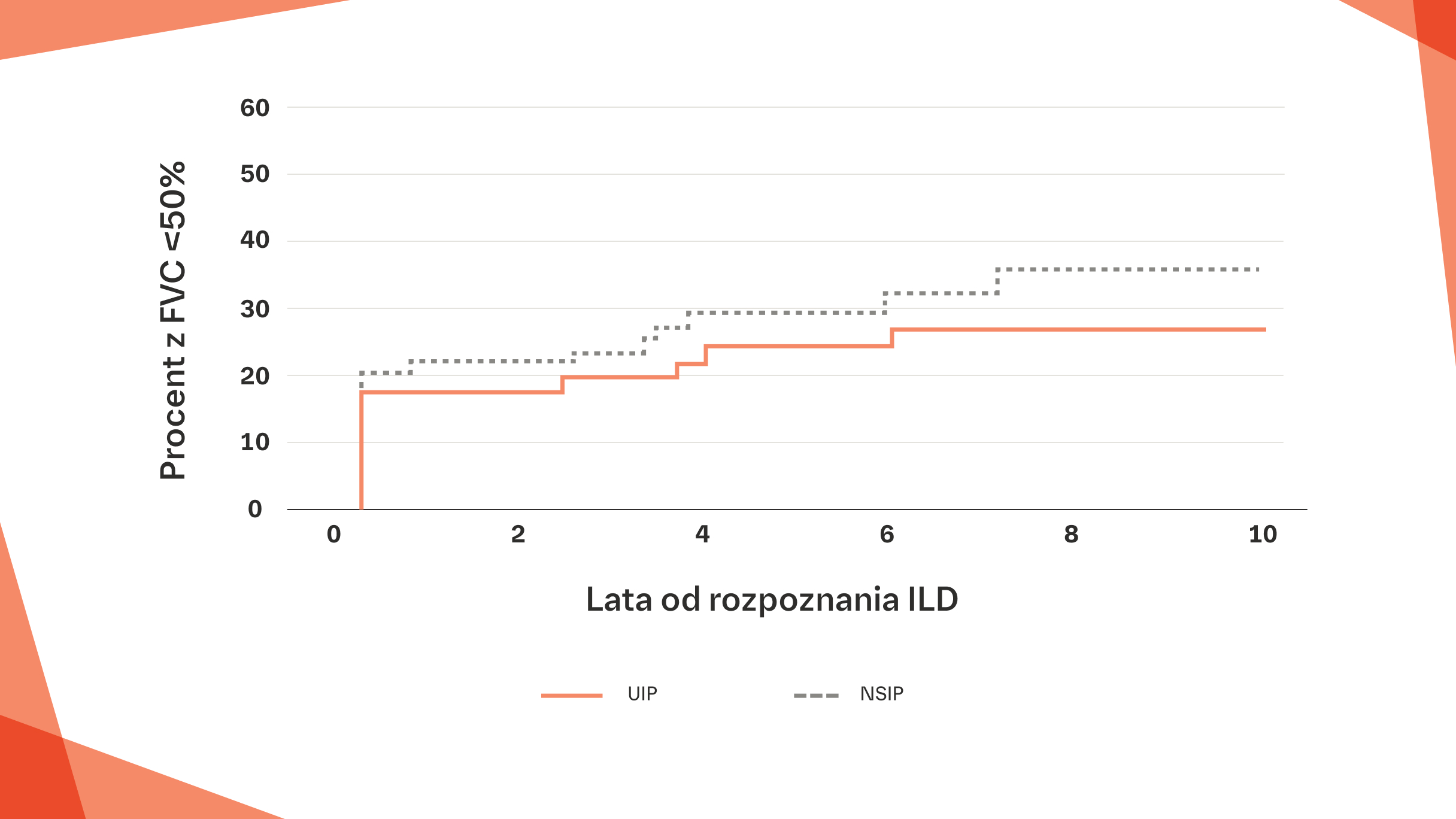
Szacowany odsetek pacjentów z FVC <50% w zależności od czasu od rozpoznania ILD u 167 pacjentów z RZS-ILD z podziałem według typu ILD.
HR: 0,86; 95% Cl: 0,27, 2,73.
Na podstawie: Zamora-Legoff JA i wsp. Arthritis Rheumatol. 2017;69:542-549.
Odsetek pacjentów, u których nastąpiła progresja do DLCO <40% wartości należnej w zależności od czasu, jaki upłynął od rozpoznania ILD11
W badaniu Mayo Clinic wzorzec UIP był częściej związany z progresją do DLCO <40% wartości należnej niż wzorzec NSIP11
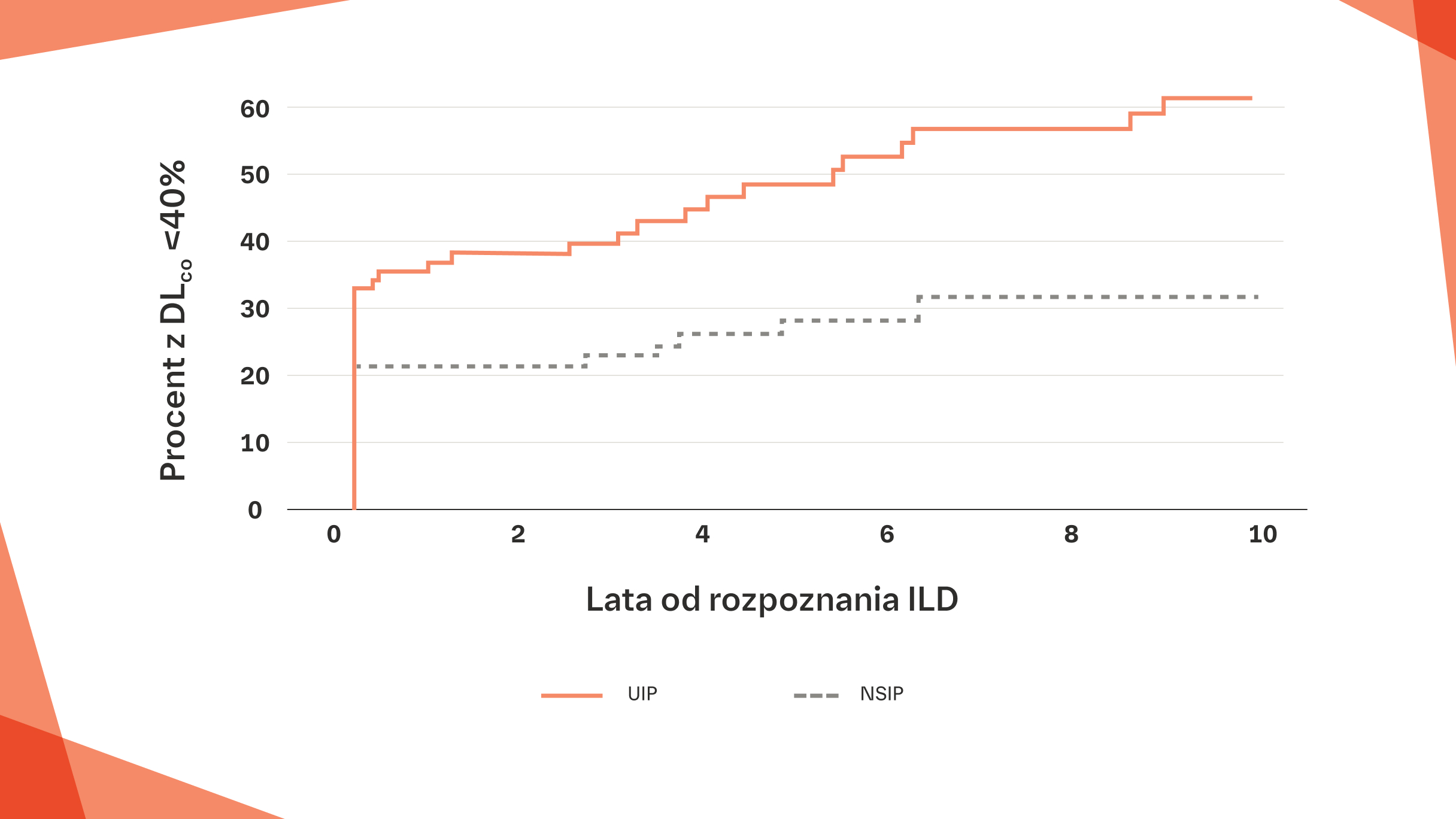
Szacowany odsetek pacjentów z DLCO <40% (lub zbyt chorych, aby można było wykonać ten test) w zależności od czasu od rozpoznania ILD u 167 pacjentów z RZS-ILD z podziałem według typu ILD.
HR: 3,29; 95% CI: 1,28, 8,41.
Na podstawie: Zamora-Legoff JA, et al. Arthritis Rheumatol. 2017;69:542-549.
PFT
Niskie wyjściowe wartości FVC i DLCO w chwili rozpoznania RZS-ILD są związane z większym ryzykiem progresji ILD11
Niskie % wartości należnych FVC lub DLCO podczas oceny wyjściowej, spadek FVC o >10% lub spadek DLCO o >15% w trakcie obserwacji są związane z progresją ILD i zwiększoną śmiertelnością u pacjentów z RZS12,13
Duże tempo spadku FVC i DLCO w ciągu pierwszych 6 miesięcy zwiększa ryzyko progresji do ciężkiego upośledzenia czynności płuc11
BADANIA SEROLOGICZNE
Stwierdzono, że wysokie wyjściowe stężenie KL‑6 w surowicy wiąże się z progresją ILD w RZS‑ILD14*
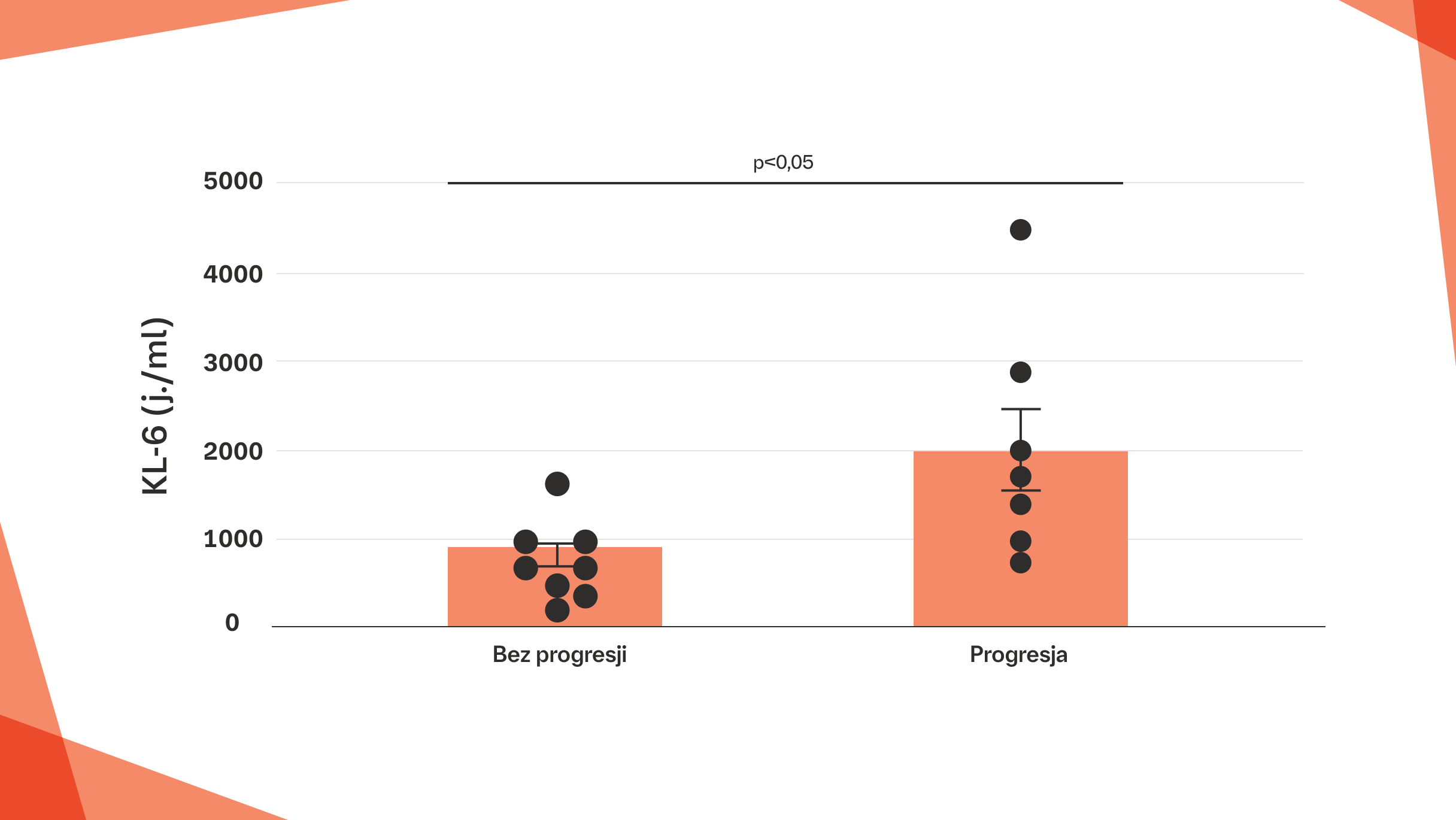
Stężenie KL-6 (j./ml) w zależności od progresji RZS-ILD
* Zgodnie z definicją progresji: >10% zwłóknienia w badaniu HRCT i spadek FVC o >15% lub spadek FVC o >10% w połączeniu ze spadkiem DLCO o >15%
Na podstawie: Avouac J, et al. PLoS One. 2020;15:e0232978.



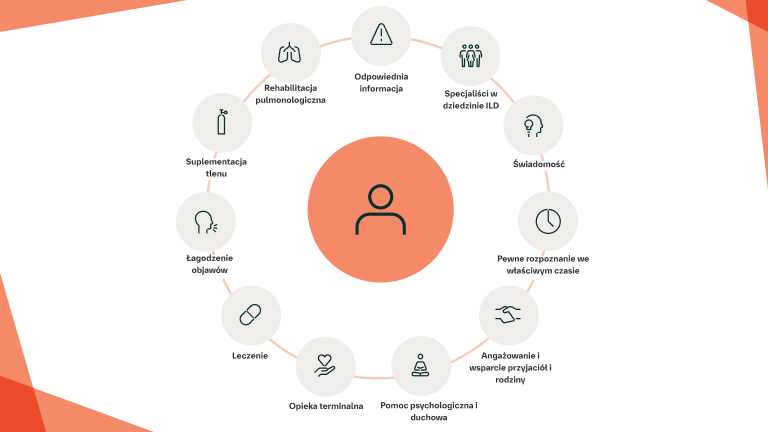
ZALECANE JEST ZAANGAŻOWANIE ZESPOŁU WIELODYSCYPLINARNEGO W CELU PODEJMOWANIA DECYZJI TERAPEUTYCZNYCH W POSTĘPUJĄCEJ ILD U PACJENTÓW Z RZS‑ILD2
Wielodyscyplinarne postępowanie z udziałem reumatologów i specjalistów w dziedzinie chorób układu oddechowego odgrywa istotną rolę w optymalizacji opieki nad pacjentami z RZS‑ILD1
Jakie inne sposoby postępowania należy brać pod uwagę?
Wczesne i regularne monitorowanie pod kątem progresji ILD w CTD‑ILD

Zespoły wielodyscyplinarne
Zapewnienie opieki paliatywnej/wspomagającej
Przypisy
-
CI: przedział ufności; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; FVC: natężona pojemność życiowa; HR: współczynnik ryzyka; HRCT: tomografia komputerowa wysokiej rozdzielczości; IIP: idiopatyczne śródmiąższowe zapalenie płuc; ILA: śródmiąższowe nieprawidłowości w płucach; ILD: śródmiąższowa choroba płuc; KL-6: Krebs von den Lungen-6; NSIP: nieswoiste śródmiąższowe zapalenie płuc; PFT: badania czynnościowe płuc; RZS: reumatoidalne zapalenie stawów; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; TLCO: współczynnik transferu płucnego dla tlenku węgla; UIP: zwykłe śródmiąższowe zapalenie płuc.
-
Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
-
Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
-
Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
-
Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
-
Cottin V, Hirani NA, Hotchkin DL, et al. Presentation, diagnosis and clinical course of the spectrum of progressive fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. doi: 10.1183/16000617.0076-2018.
-
Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019;28(151):180100. doi: 10.1183/16000617.0100-2018.
-
Kolb M and Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1):57. doi: 10.1186/s12931-019-1022-1.
-
Dawson JK, Fewins HE, Desmond J, et al. Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis. 2002;61:517–521.
-
Kawano-Dourado L, Doyle TJ, Bonfiglioli K, et al. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Esposito AJ, Chu SG, Madan R, et al. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
-
Solomon JJ, Chung JH, Cosgrove GP, et al. Predictors of mortality in rheumatoid arthritis-associated interstitial lung disease. Eur Respir J. 2016;47(2):588–596.
-
Avouac J, Cauvet A, Steelandt A, et al. Improving risk-stratification of rheumatoid arthritis patients for interstitial lung disease. PLoS One. 2020;15(5):e0232978. doi:10.1371/journal.pone.0232978.
-
Gochuico BR, Avila NA, Chow CK, et al. Progressive preclinical interstitial lung disease in rheumatoid arthritis. Arch Intern Med. 2008;168(2):159–166.
-
Assayag D, Lee JS, King Jr TE. Rheumatoid arthritis associated interstitial lung disease: a review. Medicina (B Aires). 2014;74(2):158–165.
-
Lake F and Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin Respir Crit Care Med. 2014;35(2):222–238.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
Materiały dla pacjentów po angielsku




