Monitorowanie pod kątem progresji ILD i postępowanie w razie jej wystąpienia w CTD‑ILD
Regularne monitorowanie pod kątem progresji do śródmiąższowej choroby płuc w przebiegu choroby tkanki łącznej (CTD-ILD) ma kluczowe znaczenie dla ustalenia odpowiedniego postępowania1

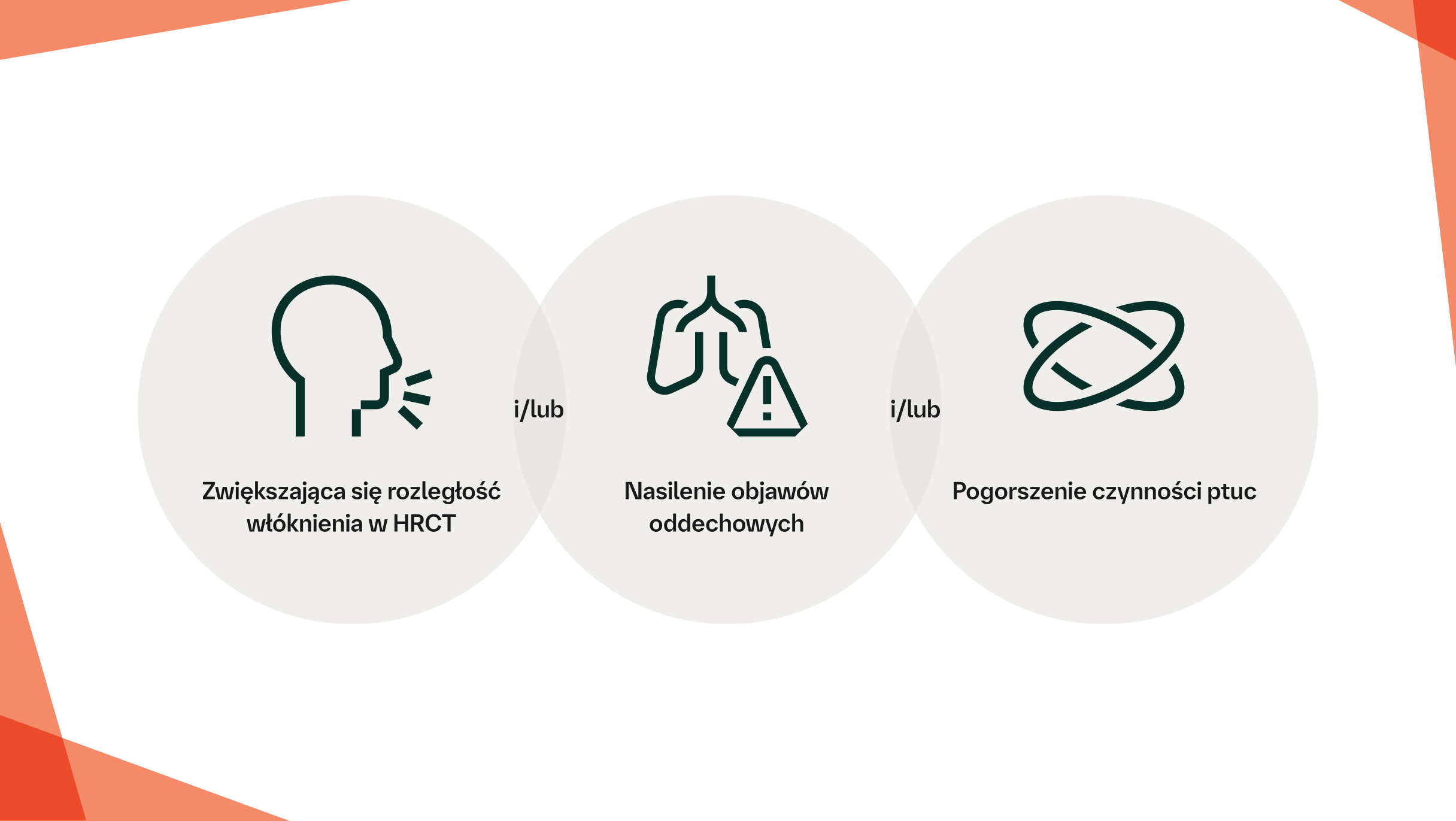
Obecnie nie ma jednolicie przyjętej definicji fenotypu postępującego włóknienia,11 a w praktyce klinicznej nie przyjęto formalnie żadnego progu ani tempa spadku12
Po wykluczeniu i wyleczeniu przyczyn alternatywnych, takich jak zakażenie dróg oddechowych, postępujące włóknienie można potwierdzić u pacjentów z ILD, którzy spełniają poniższe kryteria w dowolnym momencie w okresie 24 miesięcy pomimo leczenia w praktyce klinicznej:13
Względny spadek FVC o ≥10%
Względny spadek FVC o ≥5–<10% i względny spadek DLCO o ≥15%
Względny spadek FVC o ≥5–<10% i nasilenie objawów oddechowych
Względny spadek FVC o ≥5–<10% i zwiększona rozległość włóknienia w badaniu HRCT
Nasilenie objawów ze strony układu oddechowego i zwiększona rozległość włóknienia w badaniu HRCT
W PRZYPADKU PODEJRZENIA POSTĘPUJĄCEJ WŁÓKNIEJĄCEJ ILD CZAS MA DECYDUJĄCE ZNACZENIE9
Opóźnione wykrycie postępującego włóknienia płuc w ILD może być śmiertelnie niebezpieczne. Szacuje się, że czas przeżycia pacjentów po wykryciu postępującego włóknienia wynosi 2,5–4 lat4,9*Wczesna identyfikacja pacjentów z postępującą włókniejącą ILD może wpłynąć na decyzje dotyczące postępowania i poradnictwa dla pacjentów4
JAK MOŻNA SKRÓCIĆ CZAS POMIĘDZY ROZPOZNANIEM ILD A WYKRYCIEM FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA U PACJENTÓW?
Pacjent z CTD‑ILD może czekać średnio 2,5–3 lata od wystąpienia początkowych objawów ILD do rozpoznania postępującej włókniejącej ILD4*
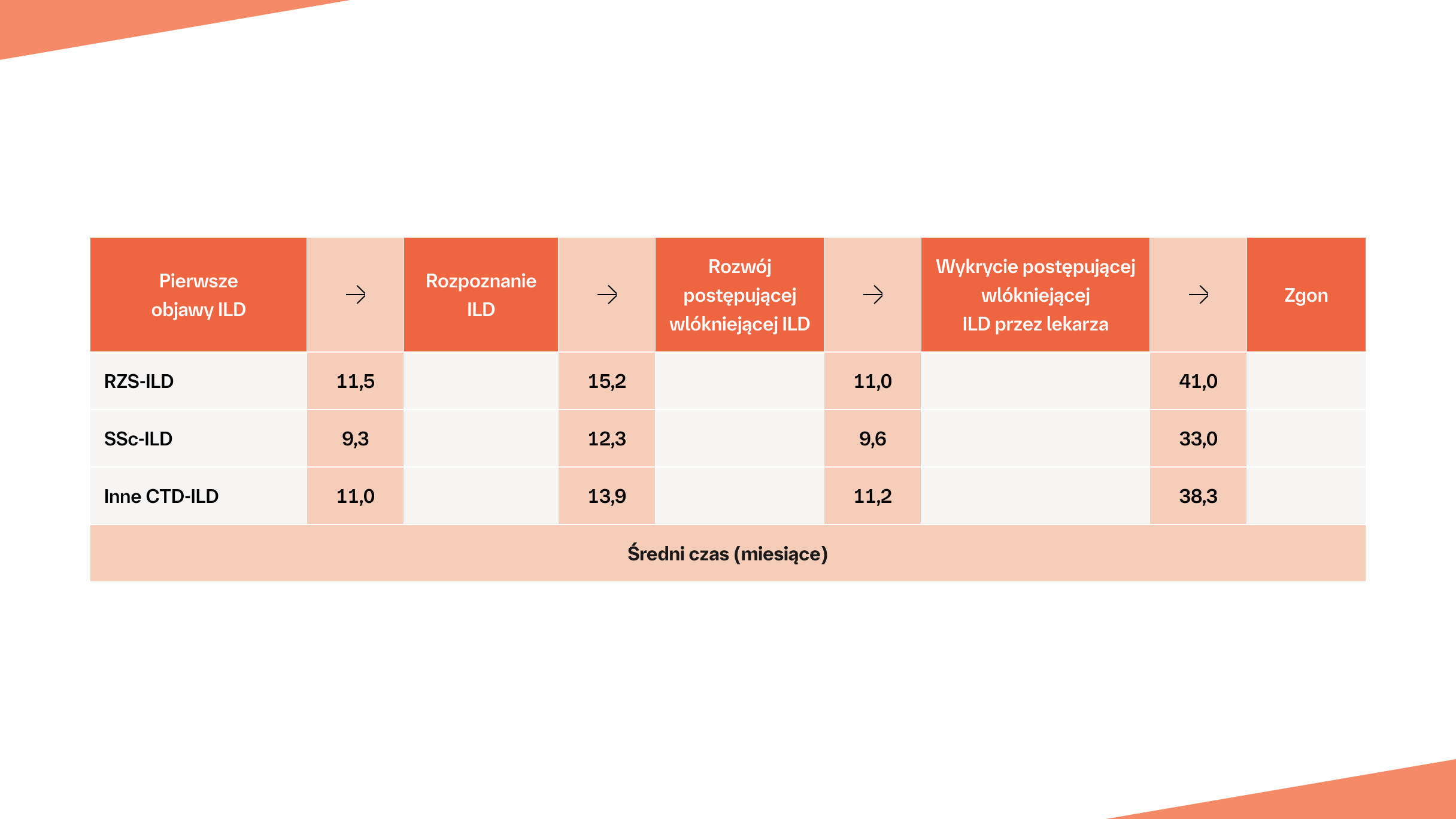
Na podstawie: Wijsenbeek M, et al. Curr Med Res Opin. 2019;35(11):2015-2024.
Droga pacjenta z postępującą włókniejącą ILD typu innego bez IPF według internetowej ankiety przeprowadzonej wśród lekarzy*
* Dane szacunkowe dotyczące liczby pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii4
W CTD‑ILD MONITOROWANIE POD KĄTEM ILD MOŻNA ZOPTYMALIZOWAĆ POPRZEZ WSPÓŁPRACĘ POMIĘDZY SPECJALISTAMI1
Ocena wielodyscyplinarna stanowi złoty standard w diagnostyce ILD oraz ocenie jej stopnia nasilenia14
W przypadkach, gdy zwołanie konsylium wielodyscyplinarnego dla pacjenta z ILD jest trudne, dyskusję wielodyscyplinarną można przeprowadzić wirtualnie lub telefonicznie, aby umożliwić udział przedstawiciela każdej specjalizacji15
Pomiary wykonywane podczas badań PFT powinny obejmować FVC, DLCO i TLC1
Pomimo ograniczeń w identyfikowaniu ILD u pacjentów z CTD, można wykorzystać test 6MWD do monitorowania progresji ILD i dostarczania informacji prognostycznych w potwierdzonej CTD-ILD – dlatego sugeruje się regularne wykonywanie oceny 6MWD1
Świadomy odbiór informacji przekazywanych przez pacjenta może pomóc w identyfikacji objawów ILD w przebiegu CTD16



LECZENIE POSTĘPUJĄCEJ CTD‑ILD NIE POWINNO CZEKAĆ1,14
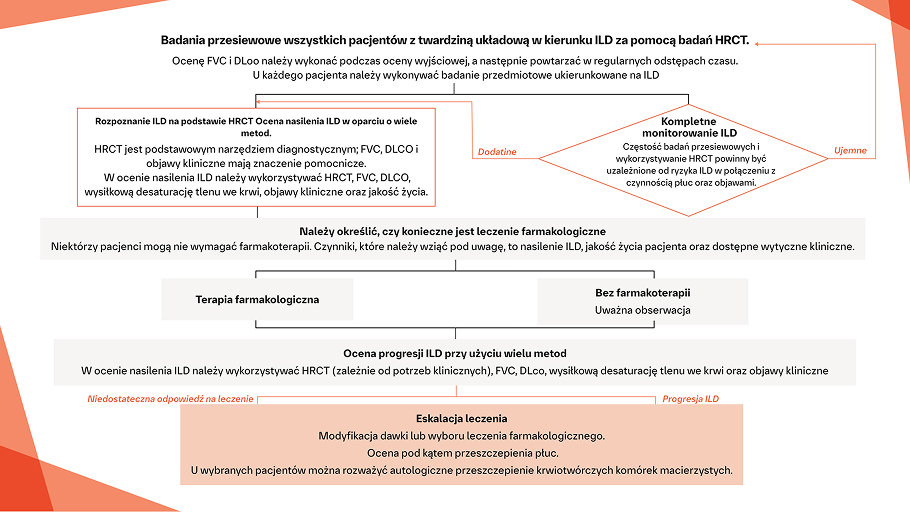
W momencie rozpoznania ILD u pacjentów z CTD oraz w trakcie ich monitorowania należy prowadzić wielodyscyplinarną dyskusję dla ustalenia optymalnego podejścia w celu spowolnienia progresji ILD12,13
Decyzja o leczeniu CTD-ILD może być oparta na tym, czy pacjent ma klinicznie ograniczoną sprawność w wyniku ILD, czy ILD ma charakter postępujący, na podstawie objawów, pomiarów fizjologicznych i/lub badań obrazowych, a także jakie cechy poza klatką piersiową wymagają leczenia1
Proponowany algorytm przedstawiający ogólne zalecenia dotyczące postępowania w przypadku ILD u pacjentów z CTD1
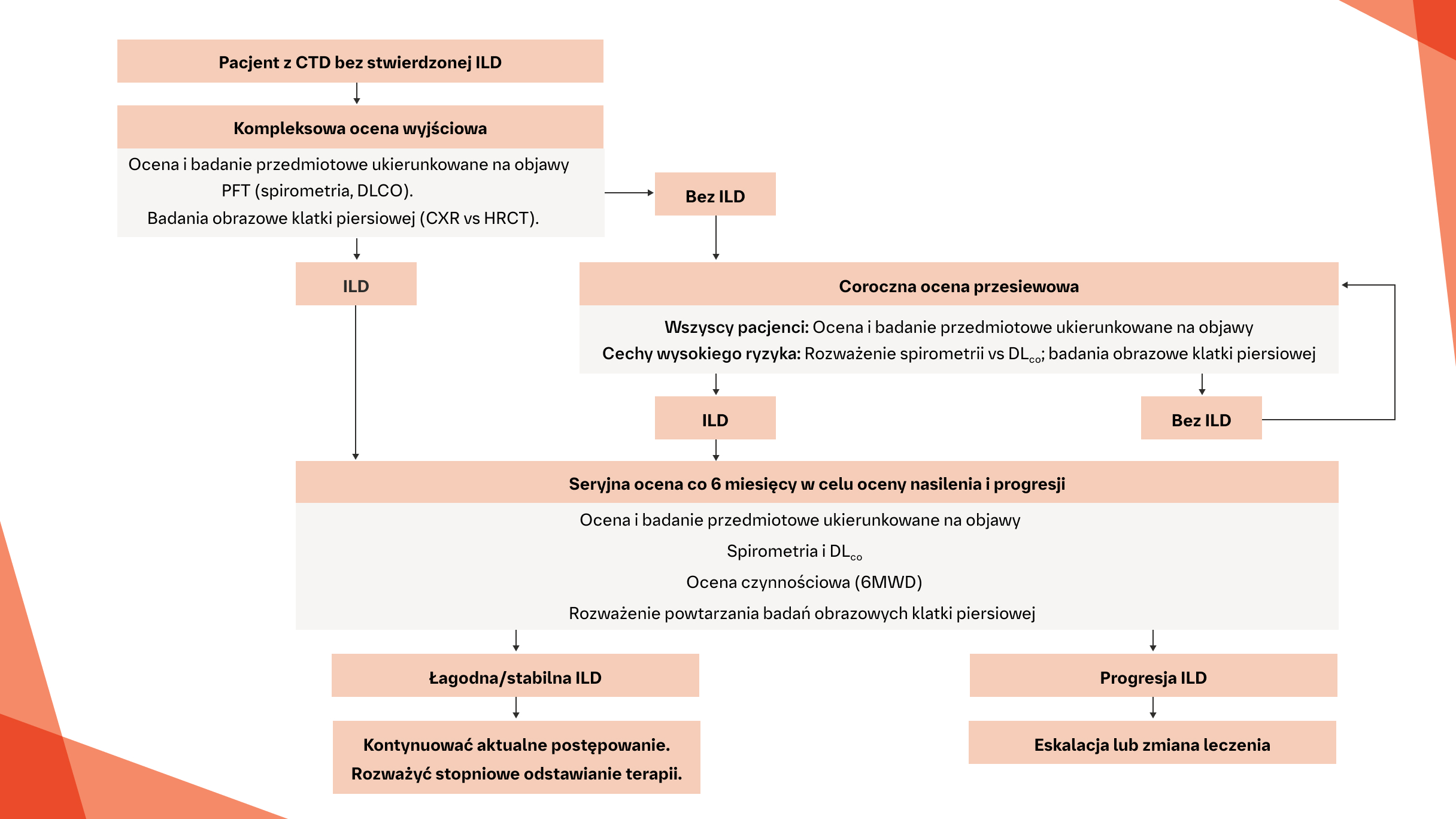
*Obecnie nie ma konsensusu co do tego, kiedy należy rozpocząć leczenie SSc-ILD.
Na podstawie: Geerts S, et al. Sacoidosis Vase Diffuse Lung Dis. 20f 7:34:326-335
WYTYCZNE DOTYCZĄCE POSTĘPOWANIA W KONKRETNYCH CTD‑ILD POWINNY MIEĆ PIERWSZEŃSTWO PRZED OGÓLNYMI WYTYCZNYM DOTYCZĄCYM POSTĘPOWANIA W CTD‑ILD17,20-23
Oto kilka przykładów:



Co jeszcze można zrobić dla pacjentów z CTD‑ILD?
Leczenie SSc‑ILD
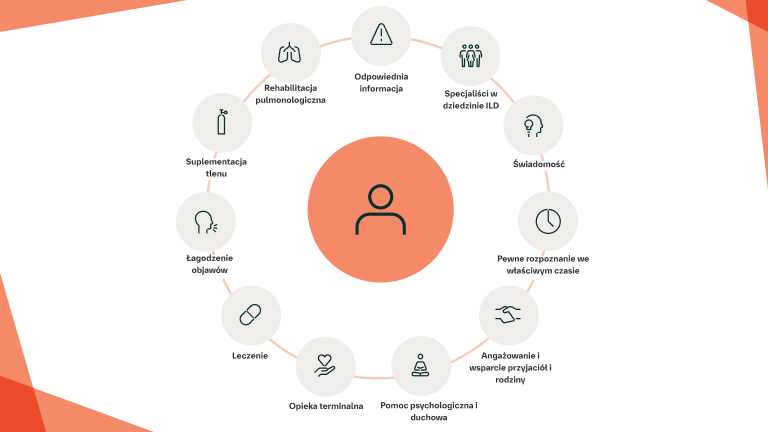
Zapewnienie opieki paliatywnej/wspomagającej

Zespoły wielodyscyplinarne
Przypisy
-
*
Dane szacunkowe dotyczące liczby pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii4
-
†
W zależności od ogólnego rokowania i ryzyka progresji ILD.
-
6MWD: dystans w 6-minutowym teście marszowym; BAL: płukanie oskrzelowo-pęcherzykowe; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CXR: badanie rentgenowskie klatki piersiowej; DLCO: pojemność dyfuzyjna płuc dla tlenku węgla; FVC: natężona pojemność życiowa; HRCT: tomografia komputerowa wysokiej rozdzielczości; HRQoL: jakość życia uwarunkowana stanem zdrowia; ILD: śródmiąższowa choroba płuc; IPF: idiopatyczne włóknienie płuc; MDD: omówienie na forum wielodyscyplinarnym; MDT: zespół wielodyscyplinarny; PFT: badania czynnościowe płuc; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; SSc-ILD: śródmiąższowa choroba płuc związana z twardziną układową; TLC: całkowita pojemność płuc.
-
Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
-
Cottin V, Wollin L, Fischer A, et al. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Olson AL, Hartmann N, Padmaja P, et al. Estimation of the Prevalence of Progressive Fibrosing Interstitial Lung Diseases: Systematic Literature Review and Data from a Physician Survey. Adv Ther. 2020; https://doi.org/10.1007/s12325-020-01578-6.
-
Wijsenbeek M, Kreuter M, Olson A, et al. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
-
Zamora-Legoff JA, Krause ML, Crowson CS, et al. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Hoffmann-Vold A, Aaløkken TM, Lund MB, et al. Predictive Value of Serial High-Resolution Computed Tomography Analyses and Concurrent Lung Function Tests in Systemic Sclerosis. Arthritis Rheumatol. 2015;67:2205–2212.
-
Marie I, Hatron PY, Dominique S, et al. Short-Term and Long-Term Outcomes of Interstitial Lung Disease in Polymyositis and Dermatomyositis. Arthritis Rheum. 2011;63:3439–3447.
-
Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Kolb M, Flaherty KR. The justification for the progressive fibrotic phenotype. Curr Opin Pulm Med 2021; online ahead of print.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
-
George PM, Spagnolo P, Kreuter M, et al. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
-
Chung JH, Goldin JG. Interpretation of HRCT Scans in the Diagnosis of IPF: Improving Communication Between Pulmonologists and Radiologists. Lung. 2018;196:561–567.
-
Mittoo S, Frankel S, LeSage D, et al. Patient perspectives in OMERACT provide an anchor for future metric development and improved approaches to healthcare delivery in connective tissue disease related interstitial lung disease (CTD-ILD). Curr Respir Med Rev. 2015;11(2):175–183.
-
Hoffmann-Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. Lancet Rheum. 2020;2:e71–e83.
-
Distler O, Assassi S, Cottin V, et al. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
-
Iqbal K, Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Lee AS, Scofield RH, Hammitt KM, et al. Consensus guidelines for evaluation and management of pulmonary disease in Sjögren’s. Chest. 2020 Oct 20. doi: 10.1016/j. chest.2020.10.011.
-
Hoffmann-Vold AM, Allanore Y, Alves M, et al. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020a;217455.
-
Distler O, Volkmann ER, Hoffmann-Vold AM, et al. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
-
Cassone G, Manfredi A, Vacchi C, et al. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
-
Ryerson CJ, Cayou C, Topp F, et al. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203-210.
-
Kreuter M, Bendstrup E, Russell A, et al. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968-980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [Epub ahead of print].
-
Sgalla G, Cerri S, Ferrari R, et al. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
Materiały dla pacjentów po angielsku




