Progresja i samopodtrzymujące się włóknienie w CTD‑ILD
Śródmiąższowe choroby płuc w przebiegu chorób tkanki łącznej (CTD-ILD) mogą mieć wspólne mechanizmy samopodtrzymywania się postępującego włóknienia płuc1,2

SAMOPODTRZYMUJĄCY SIĘ CHARAKTER POSTĘPUJĄCEGO WŁÓKNIENIA
WSPÓLNE MECHANIZMY PATOGENNE WŁÓKNIENIA PŁUC W CTD‑ILD
Poznaj mechanizmy patofizjologiczne występujące w wielu różnych włókniejących CTD-ILD, w których może rozwinąć się fenotyp postępującego włóknienia
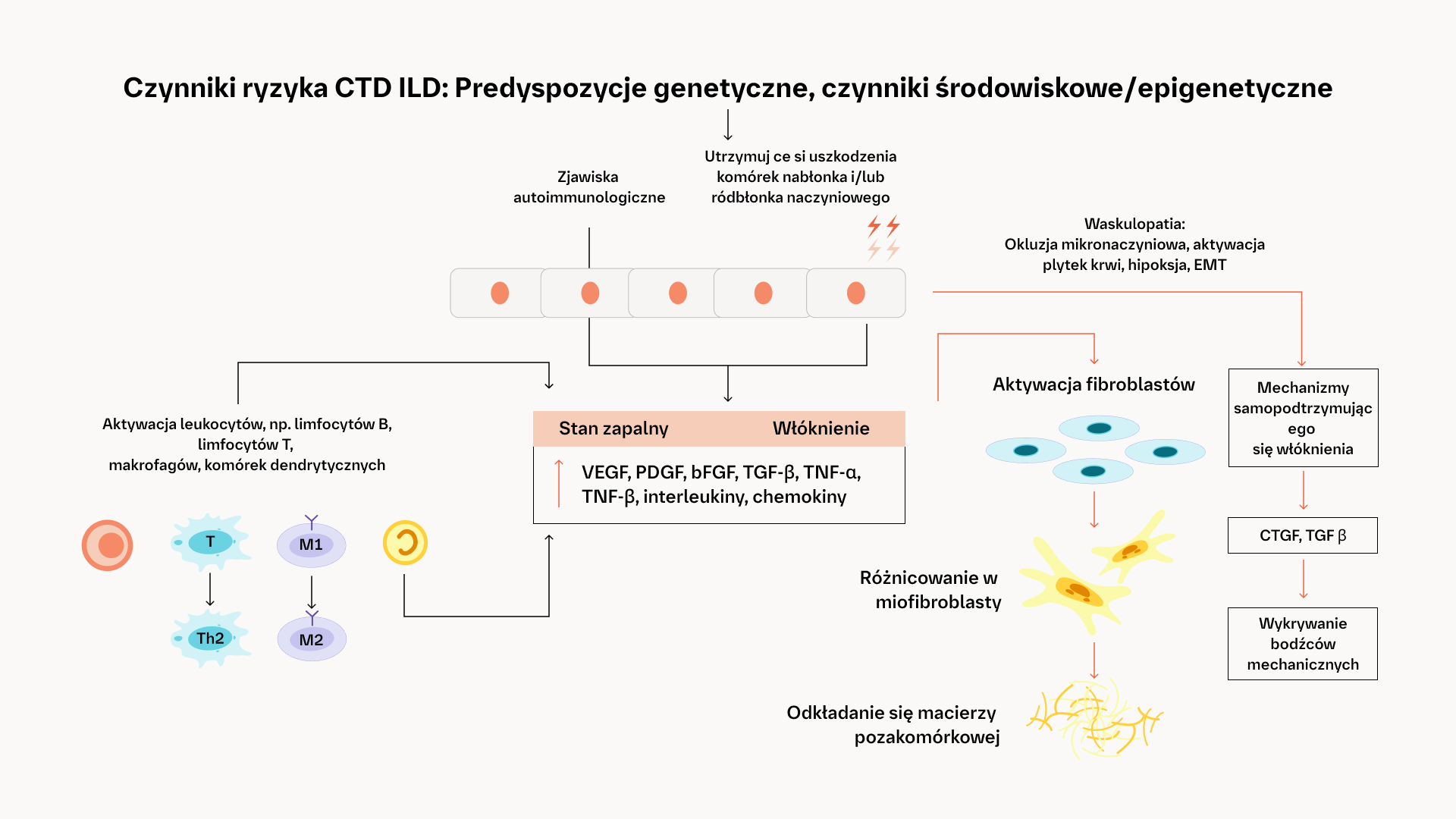
The pathogenesis of fibrotic interstitial lung disease in connective tissue diseases involves a complex interplay of inflammatory and fibrotic processes. Patients with connective tissue diseases (CTDs), such as rheumatoid arthritis, systemic sclerosis and primary Sjogren’s syndrome, develop fibrotic interstitial lung disease (ILD) via common pathogenic processes, irrespective of the underlying diagnosis or trigger. Fibrotic ILD often develops early in the course of a CTD. For example, in a study of systemic sclerosis patients, approximately 24% of systemic sclerosis-associated ILD patients showed an extent of more than 10% pulmonary fibrosis on high-resolution computed tomography at their baseline systemic sclerosis diagnosis. At the cellular level, ILD in CTDs is triggered by repeated tissue injury which induces an inflammatory response, and releases probiotic mediators, including VEGF, PDGF and FGF. These contribute to the recruitment and activation of leukocytes and fibroblasts. Resulting in a complex interplay of inflammatory and fibrotic processes. Activation of leukocytes also produces profibrotic mediators leading to further activation of the fibrotic process with excessive secretion of extracellular matrix. Excess extracellular matrix increases lung tissue stiffness, further activating fibroblasts in a feed-forward loop of self-sustaining progressive pulmonary fibrosis. Pulmonary fibrosis causes irreversible destruction and architectural disruption of the lung tissue. Based on the pathogenesis of fibrotic interstitial lung disease in connective tissue diseases, a new treatment paradigm of CTD-ILDs suggests to not only target inflammation but also fibrosis.
Samopodtrzymująca się progresja włóknienia3-5
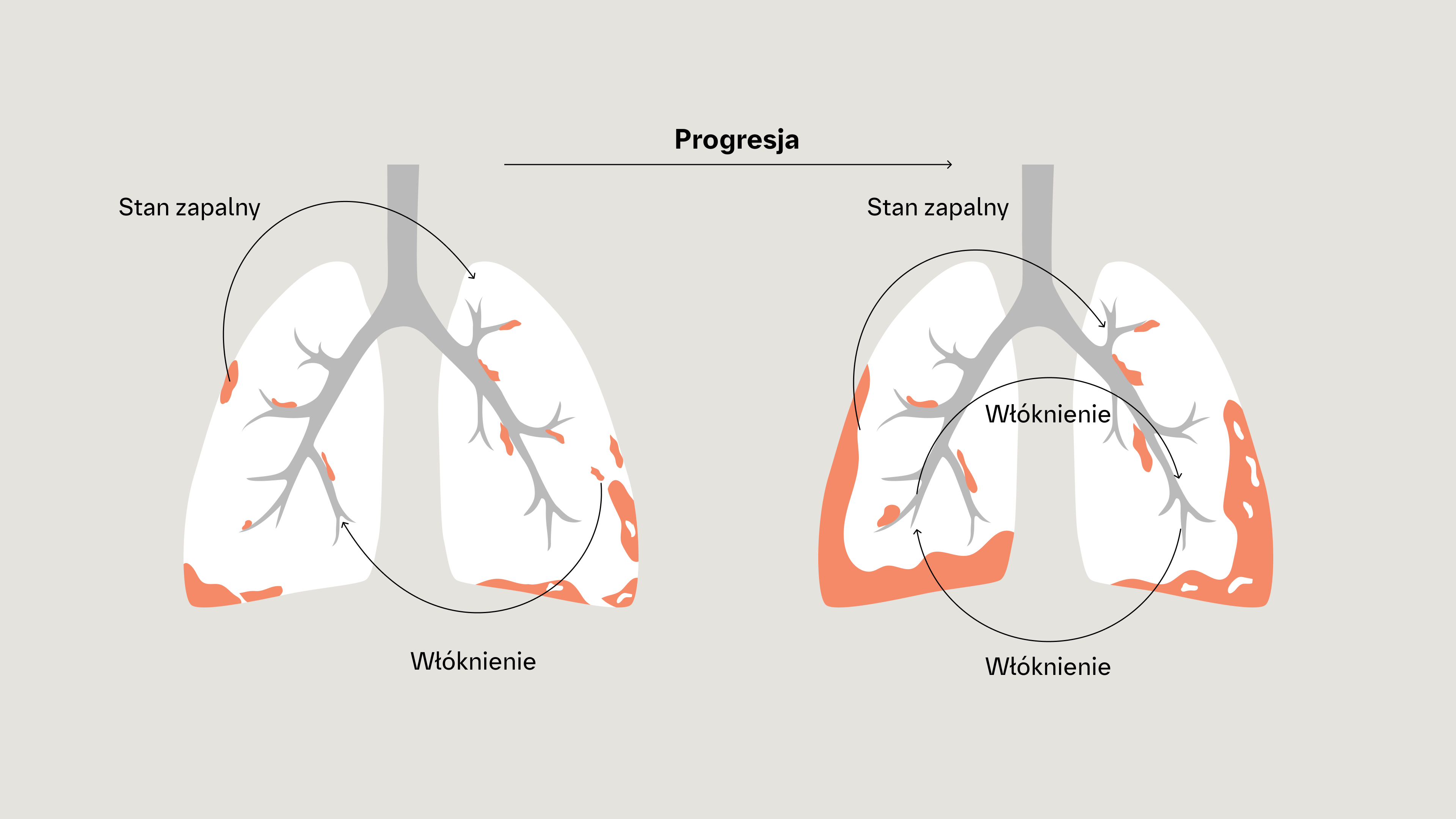
Niezależnie od rozpoznania klinicznego istnieją pewne wspólne cechy podstawowych mechanizmów patogenetycznych, które napędzają samopodtrzymujący się proces włóknienia płuc.2
Nadmierne wydzielanie macierzy pozakomórkowej może prowadzić do samopodtrzymującego się procesu postępującego włóknienia, w którym zwiększona sztywność tkanek i uwalnianie cytokin profibrotycznych dodatkowo aktywuje fibroblasty.1
W pętli sprzężenia zwrotnego zwiększona sztywność tkanki płucnej dodatkowo aktywuje i stymuluje fibroblasty do napędzania samopodtrzymującego się procesu włóknienia6,7
Gdy włóknienie płucne przyjmie charakter samopodtrzymujący się, fibroblasty mogą stać się częściowo niezależne od zewnętrznej stymulacji i inicjującej odpowiedzi zapalnej8-10
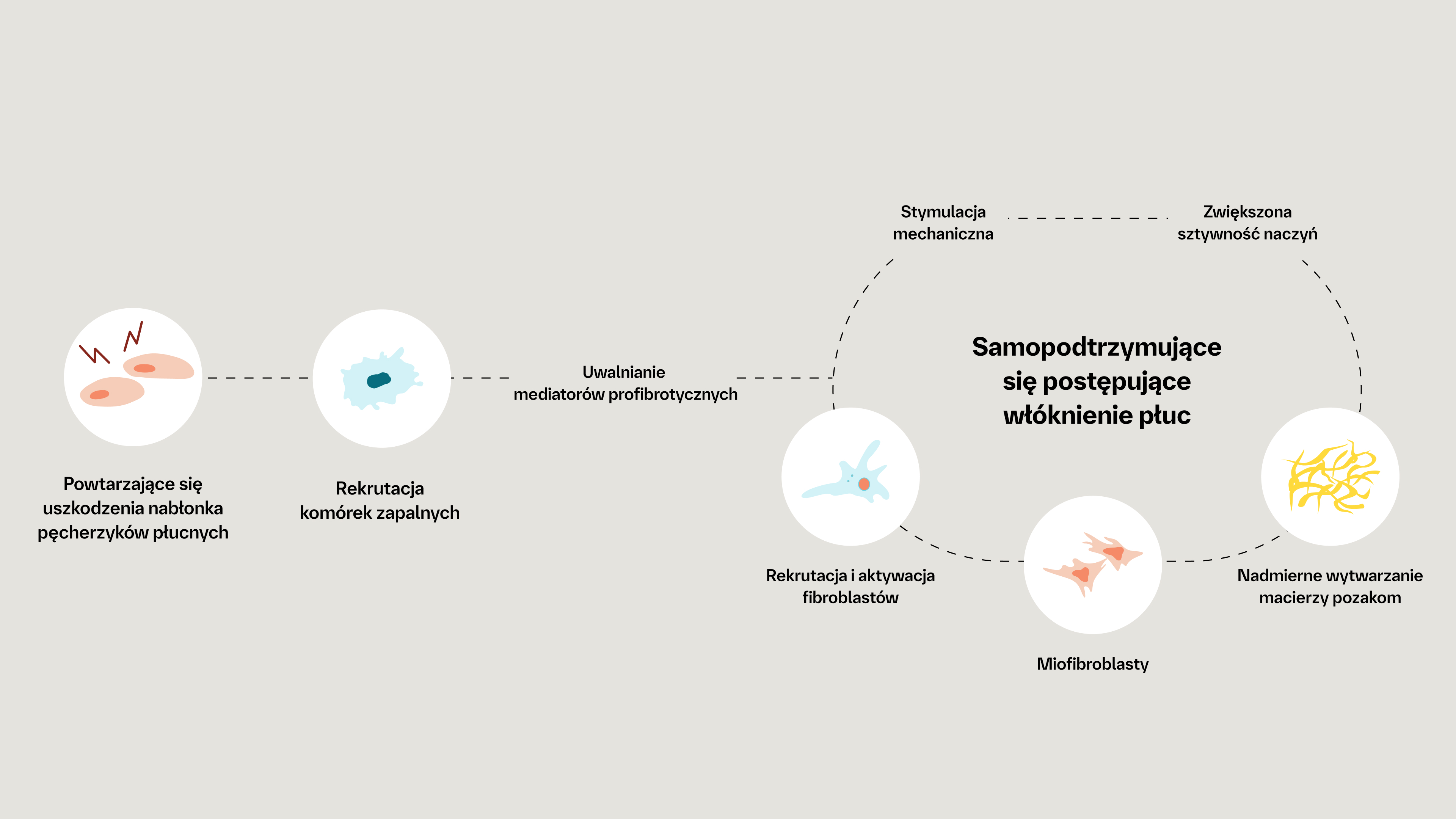
Na podstawie: Wollin L, et al. Eur Respir J. 2019;54:1900161.4
Mechanizmy leżące u podstaw samopodtrzymującego się włóknienia w patogenezie CTD‑ILD1,5,11-18
W jaki sposób można monitorować i leczyć progresję włóknienia u pacjentów z CTD‑ILD?
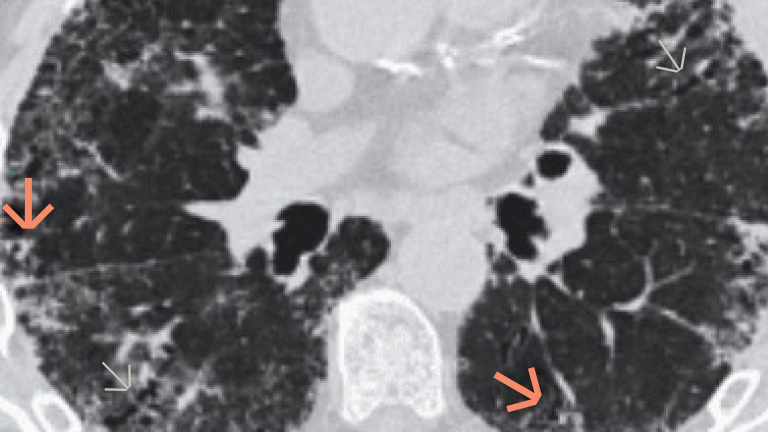
Badanie włókniejącej CTD‑ILD za pomocą obrazowania HRCT
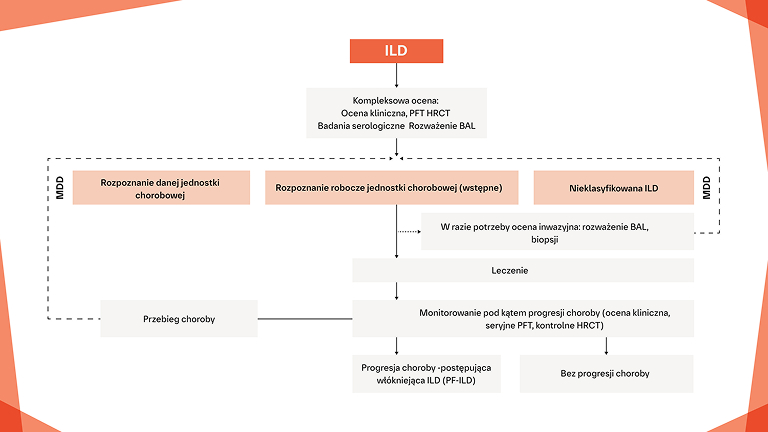
Wczesne i regularne monitorowanie pod kątem progresji ILD w CTD‑ILD
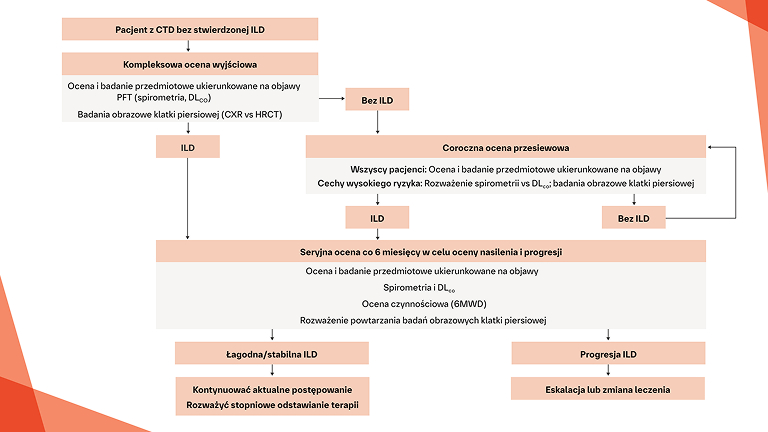
Postępowanie w postępującej włókniejącej CTD‑ILD
Przypisy
-
bFGF: podstawowy czynnik wzrostu fibroblastów; CTD: choroba tkanki łącznej; CTD-ILD: śródmiąższowa choroba płuc związana z chorobą tkanki łącznej; CTGF: czynnik wzrostu tkanki łącznej; EMT: przemiana tkanki nabłonkowej w mezenchymalną; HRCT: tomografia komputerowa wysokiej rozdzielczości; ILD: śródmiąższowa choroba płuc; MMP: metaloproteinaza macierzy; PDGF: płytkopochodny czynnik wzrostu; PFT: badania czynnościowe płuc; RZS-ILD: śródmiąższowa choroba płuc związana z reumatoidalnym zapaleniem stawów; TGF-β: transformujący czynnik wzrostu-β; TNF-α: czynnik martwicy nowotworów-α; TNF-β: czynnik martwicy nowotworów-β; VEGF: czynnik wzrostu śródbłonka naczyniowego.
-
Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
-
Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Saketkoo LA, Scholand MB, Lammi MR, et al. Patient-reported outcome measures in systemic sclerosis–related interstitial lung disease for clinical practice and clinical trials. Scleroderma Relat Disord. 2020;5(2 Suppl): 48–60.
-
Wollin L, Distler JHW, Redente EF, et al. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J. 2019;54(3):1900161. doi: 10.1183/13993003.00161-2019.
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10:728–739.
-
Huang X, Yang N, Fiore VF, et al. Matrix stiffness-induced myofibroblast differentiation is mediated by intrinsic mechanotransduction. Am J Respir Cell Mol Biol. 2012;47(3):340–348.
-
Froese AR, Shimbori C, Ballaye PS, et al. Stretch-induced Activation of Transforming Growth Factor-β1 in Pulmonary Fibrosis. Am J Respir Crit Care Med. 2016;194(1):84–96.
-
Distler J, et al. Shared and distinct mechanisms of fibrosis. Nat Rev Rheumatol 2019(b):15:705–30.
-
Kolb M, Flaherty KR. The justification for the progressive fibrotic phenotype. Curr Opin Pulm Med 2021; online ahead of print.
-
Leask A. The hard problem: Mechanotransduction perpetuates the myofibroblast phenotype in scleroderma fibrosis. Wound Rep Reg. 2021;29:582–587.
-
Cutolo M, Soldano S, Smith V. Pathophysiology of systemic sclerosis: current understanding and new insights. Exp Rev Clin Immunol. 2019;15:753–764.
-
Khanna D, Tashkin DP, Denton CP, et al. Etiology, Risk Factors, and Biomarkers in Systemic Sclerosis with Interstitial Lung Disease. Am J Respir Crit Care Med. 2019; doi: 10.1164/rccm.201903-0563CI.
-
Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. Eur Respir Rev. 2015;24(135):1–16.
-
Cavagna L, Monti S, Grosso V, et al. The multifaceted aspects of interstitial lung disease in rheumatoid arthritis. Biomed Res Int. 2013;2013:759760. doi: 10.1155/2013/759760.
-
Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder. J Clin Invest. 2007;117:557-567.
-
Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
-
Nicolosi P A, Tombetti E, Maugeri N, et al. Vascular Remodelling and Mesenchymal Transition in Systemic Sclerosis. Stem Cell Int. 2016; doi: 10.1155/2016/4636859.
-
Flaherty KR, Brown KK, Wells AU, et al. Design of the PF-ILD trial: a doubleblind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212. doi: 10.1136/bmjresp-2017-000212.
-
Cottin V, Hirani N, Hotchkin D, et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
-
Geerts S, Wuyts W, De Langhe E, et al. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Chowaniec M, Skoczyńska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4): 249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc–ILD). Respir Res. 2019a;20(1):13.
Materiały dla pacjentów po angielsku




