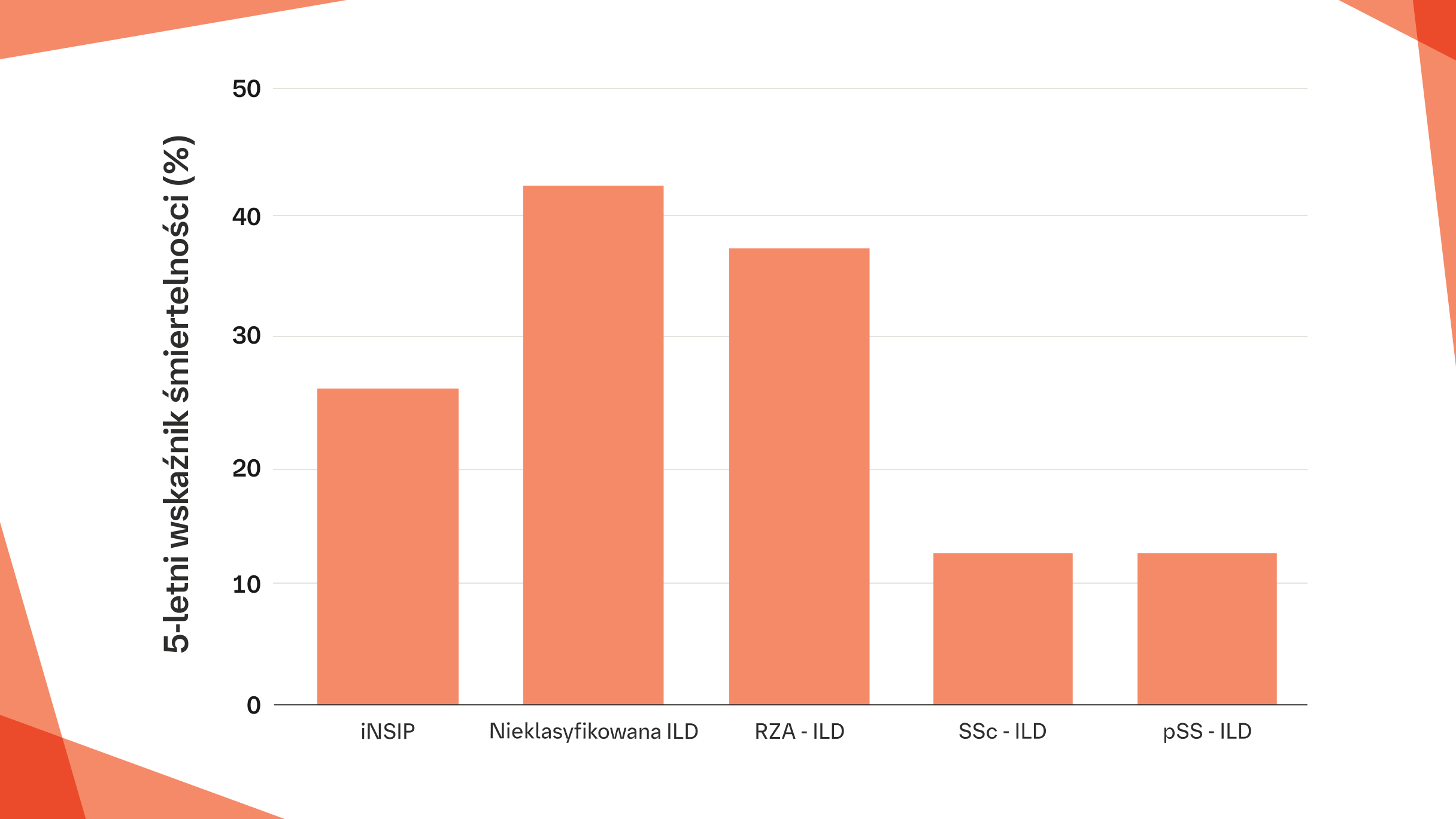
Śmiertelność w ILD
Włóknienie płuc jest kluczowym czynnikiem powodującym wczesną śmiertelność u pacjentów z włókniejącą ILD1–8

5‑letni wskaźnik śmiertelności w iNSIP pochodzi z badania retrospektywnego.7 5‑letnie wskaźniki śmiertelności w nieklasyfikowanej ILD, RZS‑ILD, SSc‑ILD i pSS‑ILD stanowią wartości środkowe z następujących przedziałów śmiertelności 5‑letniej: nieklasyfikowana ILD: 30–54%13, RZS‑ILD: 35–39%14,15, SSc‑ILD: 10–18%16, pSS‑ILD: 12–16%17–19.
U PACJENTÓW Z TYPAMI ILD INNYMI NIŻ IPF MOŻE ROZWINĄĆ SIĘ FENOTYP POSTĘPUJĄCEGO WŁÓKNIENIA, KTÓRY JEST ZWIĄZANY Z RYZYKIEM WCZESNEJ ŚMIERTELNOŚCI, TAK JAK W IPF20
Fenotyp postępującego włóknienia charakteryzuje się zwiększoną rozległością włóknienia, bardziej nasilonymi objawami oddechowymi oraz pogorszeniem czynności płuc9,21–23
U pacjentów z rozpoznanym IPF lub typem ILD innym niż IPF z postępującym włóknieniem płuc rokowanie jest bardzo niekorzystne 20,24
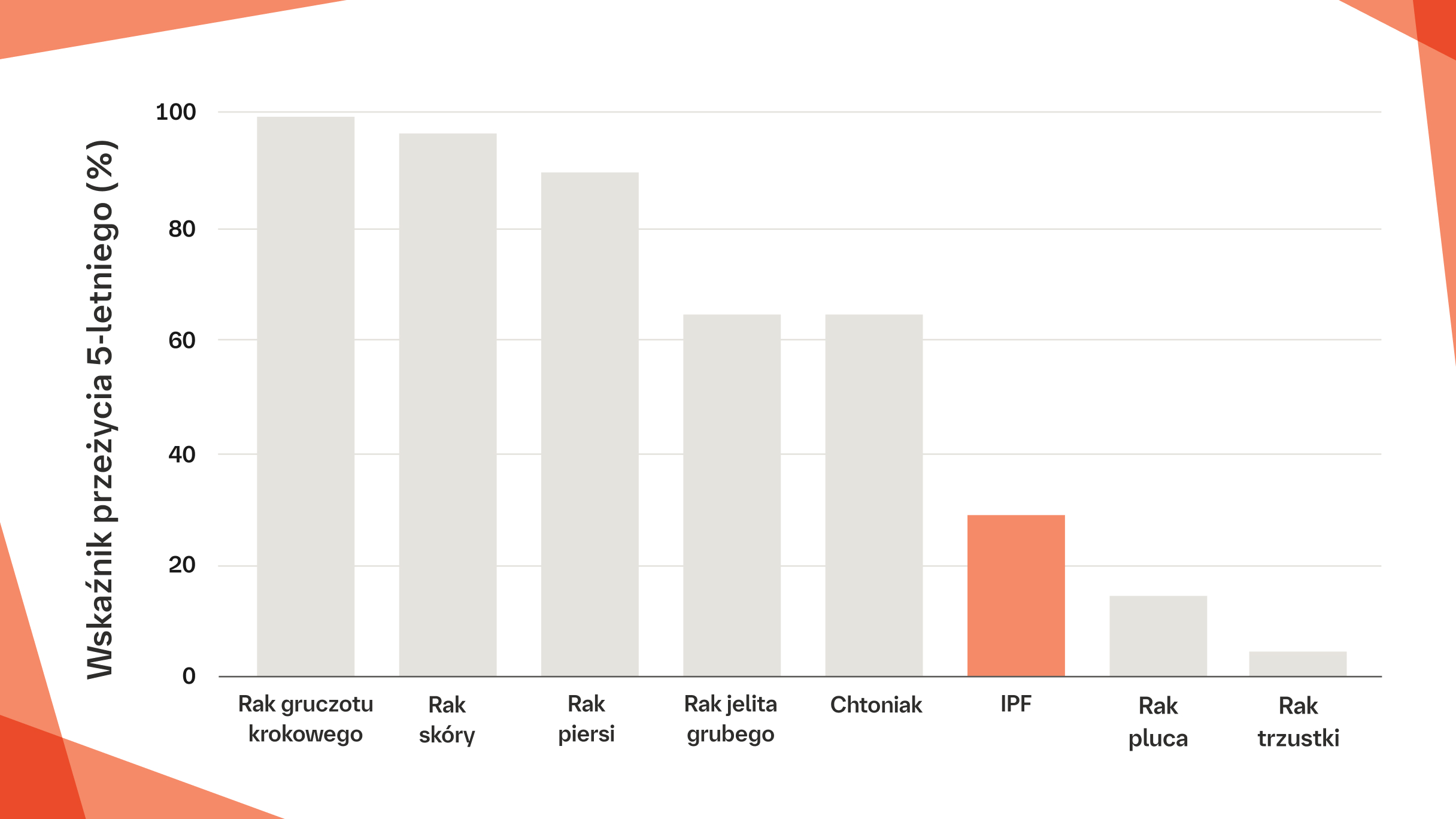
JAK PRZEDSTAWIA SIĘ ROKOWANIE W PRZYPADKU IPF W PORÓWNANIU Z INNYMI CHOROBAMI?
W IPF czas przeżycia 5‑letniego jest gorszy niż w wielu innych nowotworach, w tym w raku piersi, gruczołu krokowego, jelita grubego, skóry oraz w chłoniaku8
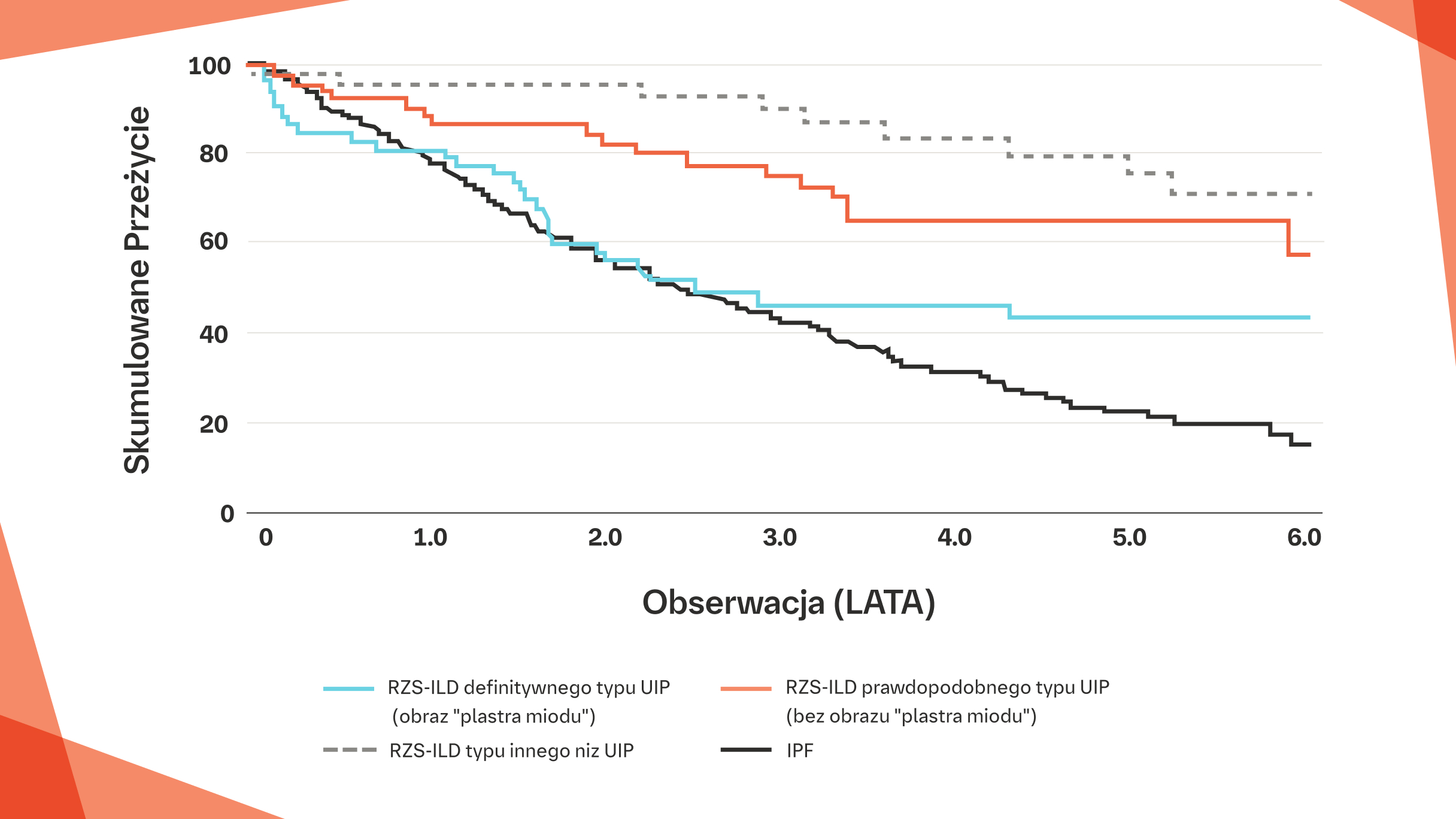
Krzywa Kaplana‑Meiera przedstawiająca śmiertelność pacjentów z IPF w porównaniu z pacjentami z RZS‑ILD w podziale zgodnym z wytycznymi w kwestii diagnostyki IPF na podstawie obrazu HRCT według
Towarzystwa Fleischnera. Na podstawie: Jacob J i wsp. Eur Respir J. 2019;53:pii1800869.
RZS‑ILD definitywnego typu UIP (obraz „plastra miodu”): Przeżycie 3‑letnie 48% i 6‑letnie 45%, n=55. Mediana czasu przeżycia: 3,5 roku
RZS‑ILD prawdopodobnego typu UIP (bez obrazu „plastra miodu”): Przeżycie 3‑letnie 76% i 6‑letnie 58%, n=56. Mediana czasu przeżycia: 4,6 roku
RZS‑ILD typu innego niż UIP: Przeżycie 3‑letnie 92% i 6‑letnie 75%, n=46. Mediana czasu przeżycia: 5,3 roku
IPF: Przeżycie 3‑letnie 42% i 6‑letnie 18%, n=284. Mediana czasu przeżycia: 2,9 roku
W porównaniu z włókniejącym NSIP, u pacjentów z IPF wskaźnik przeżycia jest gorszy27
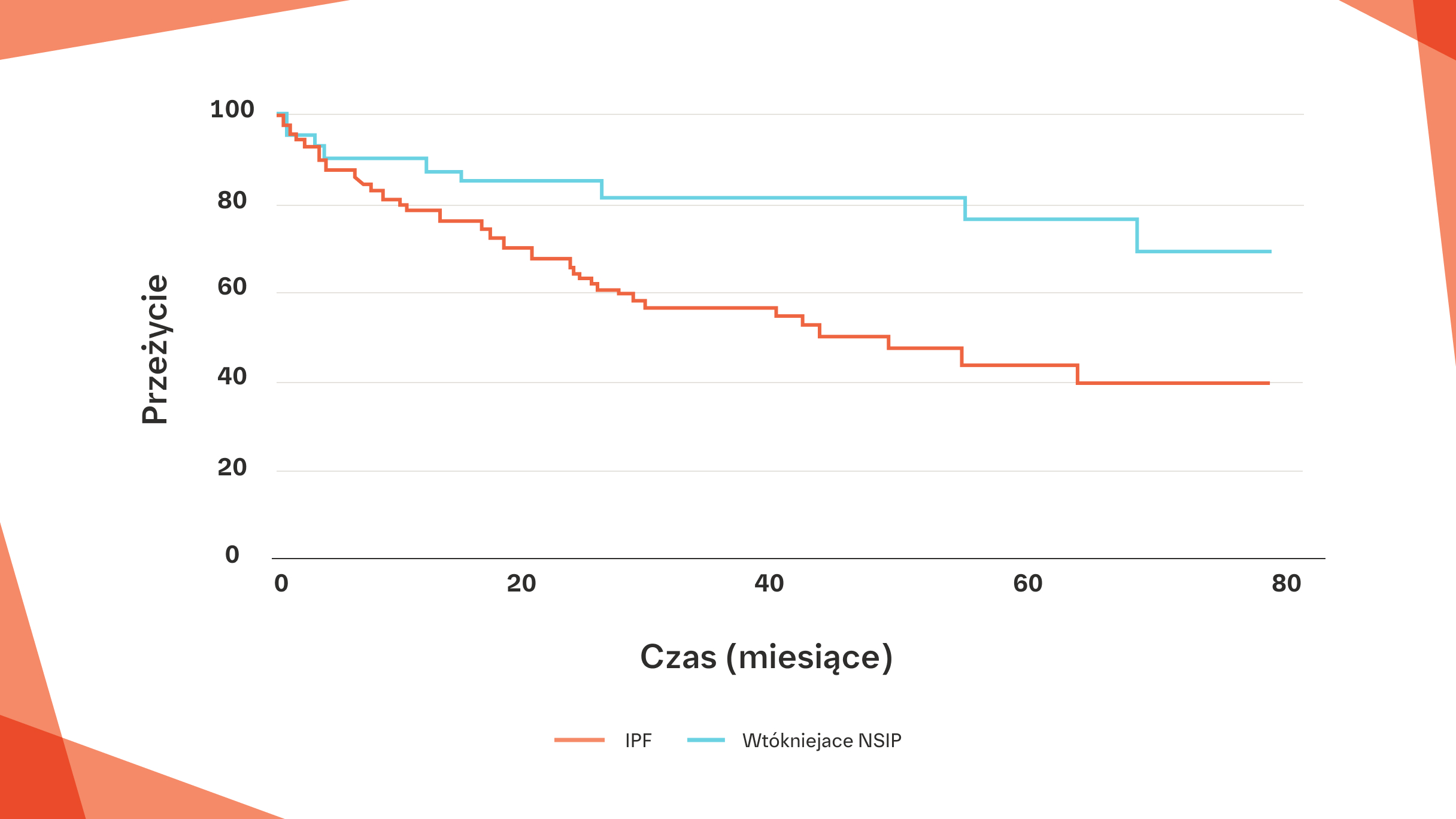
Wskaźnik przeżycia 5‑letniego u pacjentów z włókniejącym NSIP (n=41) wynosił 76,2% w porównaniu z 43,8% u pacjentów z IPF (n=131) (p=0,007).
6‑miesięczne zmiany FVC i początkowej DLco oraz płeć męska są statystycznie istotnymi czynnikami predykcyjnymi przeżycia u pacjentów z włókniejącym NSIP i IPF27
| Współczynnik ryzyka | 95% CI | Wartość P | |
| Wiek | 1.027 | 0.992–1.064 | 0.134 |
| Płeć* | 2.724 | 1.277–5.813 | 0.010 |
| Rozpoznanie NSIP | 0.854 | 0.349–2.093 | 0.730 |
| Początkowa FVC, % wartości należnej* | 0.987 | 0.964–1.010 | 0.262 |
| Początkowa DLco, % wartości należnej* | 0.972 | 0.949–0.996 | 0.022 |
| 6‑miesięczna zmiana FVC* | 0.925 | 0.893–0.958 | <0.001 |
| PaO2 w spoczynku | 0.995 | 0.961–1.031 | 0.798 |
Wyniki analizy wieloczynnikowej czynników prognostycznych u pacjentów z włókniejącym NSIP (n=41) oraz IPF (n=131) po 6 miesiącach obserwacji.
* Analizowane jako zmienne ciągłe.
U PACJENTÓW Z POSTĘPUJĄCYMI WŁÓKNIEJĄCYMI ILD ISTNIEJE RYZYKO WCZESNEJ ŚMIERTELNOŚCI20


Zrozumienie i zidentyfikowanie ryzyka śmiertelności u pacjentów
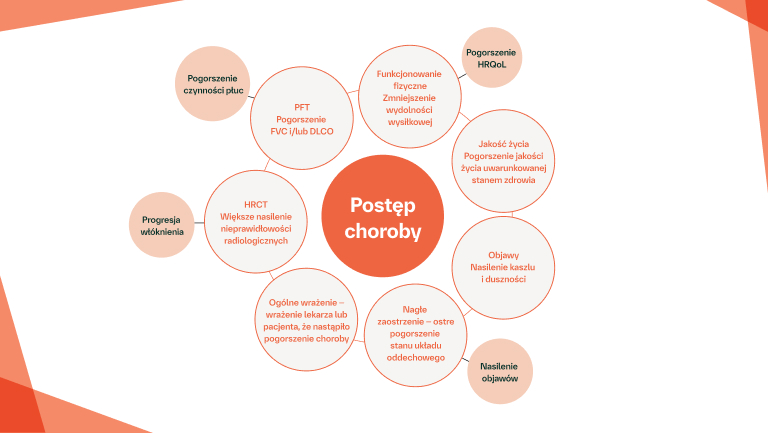
W ILD typu innego niż IPF również może rozwinąć się fenotyp postępujący
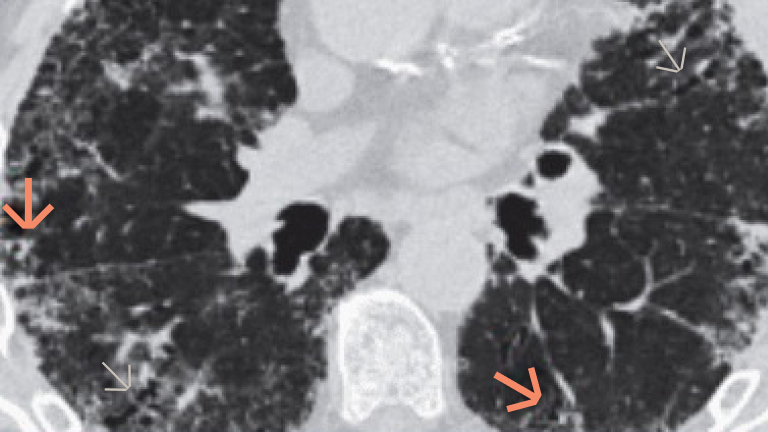
Badanie włókniejącej ILD za pomocą obrazowania HRCT
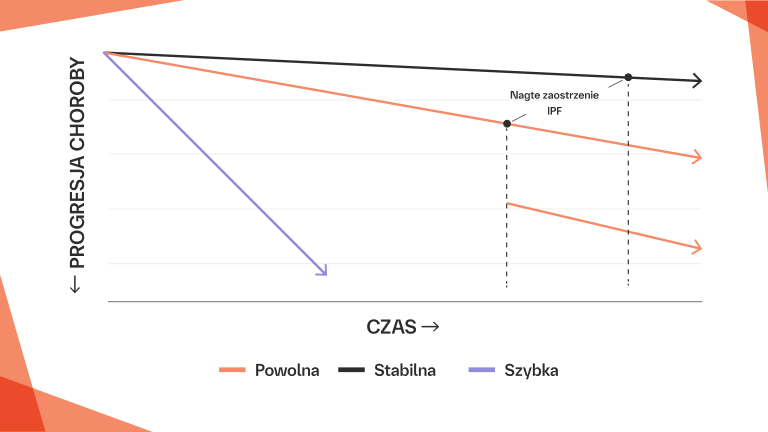
Nagłe zaostrzenie ILD
Przypisy
-
*
Szacowany czas od wykrycia postępującego włóknienia do zgonu.
-
†
Dane szacunkowe dotyczące liczby pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii.20
-
Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
-
Mathai SC i Danoff SK. Management of interstitial lung disease associated with connective tissue disease. BMJ. 2016;352:h6819.
-
Wallace B, Vummidi D, Khanna D. Management of connective tissue diseases associated interstitial lung disease: a review of the published literature. Curr Opin Rheumatol. 2016;28(3):236–245.
-
Spagnolo P, Cordier JF, Cottin V. Connective tissue diseases, multimorbidity and the ageing lung. Eur Respir J. 2016;47(5):1535–1558.
-
Vacchi C, Sebastiani M, Cassone G i wsp. Therapeutic options for the treatment of interstitial lung disease related to connective tissue diseases. A narrative review. J Clin Med. 2020;9(2):407. doi: 10.3390/jcm9020407.
-
Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
-
Park IN, Jegal Y, Kim DS i wsp. Clinical course and lung function change of idiopathic nonspecific interstitial pneumonia. Eur Respir J. 2009;33(1):68–76.
-
Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology. Eur Respir J. 2010;35(3):496–504.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of ... in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Patterson KC, Strek ME. Pulmonary fibrosis in sarcoidosis. Clinical features and outcomes. Ann Am Thorac Soc. 2013;10(4):362–370.
-
Caban JJ, Yao J, Bagci U, Mollura DJ. Monitoring pulmonary fibrosis by fusing clinical, physiological, and computed tomography features. Conf Proc IEEE Eng Med Biol Soc. 2011;6216–6219.
-
Wells AU, Brown KK, Flaherty KR, Kolb M, Thannickal VJ, w imieniu Grupy Roboczej ds. Konsensusu w kwestii IPF. Eur Resp J. 2018;51:1800692.
-
Guler SA, Ellison K, Algamdi M i wsp. Heterogeneity in Unclassifiable Interstitial Lung Disease: A Systematic Review and Meta-Analysis. Ann Am Thorac Soc. 2018;15:854–863.
-
Hyldgaard C, Hilberg O, Pedersen AB i wsp. A population-based cohort study of rheumatoid arthritis-associated interstitial lung disease: comorbidity and mortality. Ann Rheum Dis. 2017;76(10):1700–1706.
-
Raimundo K, Solomon JJ, Olson AL i wsp. Rheumatoid arthritis - interstitial lung disease in the United States: prevalence, incidence, and healthcare costs and mortality. J Rheumatol. 2019;46(4):360–369.
-
Bouros D, Wells AU, Nicholson AG i wsp. Histopathologic Subsets of Fibrosing Alveolitis in Patients with Systemic Sclerosis and Their Relationship to Outcome. Am J Respir Crit Care Med. 2002;165:1581–1586.
-
Palm Ø, Garen T, Enger TV i wsp. Clinical pulmonary involvement in primary Sjögren’s syndrome: prevalence, quality of life and mortality—a retrospective study based on registry data. Rheumatology. 2013;52:173–179.
-
Ito I, Nagai S, Kitaichi M i wsp. Pulmonary Manifestations of Primary Sjögren’s Syndrome: A Clinical, Radiologic, and Pathologic Study. Am J Respir Crit Care Med. 2005;171:632–638.
-
Enomoto Y, Takemura T, Hagiwara E i wsp. Prognostic Factors in Interstitial Lung Disease Associated with Primary Sjogren’s Syndrome: A Retrospective Analysis of 33 Pathologically-Proven Cases. PLoS One. 2013;8:e73774.
-
Wijsenbeek M, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Nathan SD, du Bois RM. Idiopathic pulmonary fibrosis trials: recommendations for the jury. Eur Respir J. 2011;38(5):1002–1004.
-
Jacob J, Hirani N, van Moorsel CHM i wsp. Predicting outcomes in rheumatoid arthritis related interstitial lung disease. Eur Respir J. 2019;53:1800869.
-
Jegal Y, Kim DS, Shim TS i wsp. Physiology Is a Stronger Predictor of Survival than Pathology in Fibrotic Interstitial Pneumonia. Am J Respir Crit Care Med. 2005;171:639–644.
-
Bongartz T, Nannini C, Medina-Velasquez YF i wsp. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010;62(6):1583–1591.
-
Cassone G, Manfredi A, Vacchi C i wsp. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
-
Olson AL, Swigris JJ, Sprunger DB i wsp. Rheumatoid Arthritis-Interstitial Lung Disease-associated Mortality. Am J Respir Crit Care Med. 2011;183:372–378.
-
Hyldgaard C, Ellingsen T, Hilberg O i wsp. Rheumatoid arthritis-associated interstitial lung disease: clinical characteristics and predictors of mortality. Respiration. 2019;98(5):455–460.
-
Cappelli S, Bellando Randone S, Camiciottoli G i wsp. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24;411–419.
-
Distler O, Assassi S, Cottin V i wsp. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55;1902026.
-
Distler O, Volkmann ER, Hoffmann-Vold AM i wsp. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15;1009–1017.
-
Tyndall AJ i wsp. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010;69(10):1809–1815. doi:10.1136/ ard.2009.114264.
-
Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002. Ann Rheum Dis. 2007;66(7):940–944. doi:10.1136/ard.2006.066068.
-
Roofeh D, Jaafar S, Vummidi D i wsp. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31;241–249.
-
Brauner M i wsp. Imagerie des pneumopathies infiltrantes diffuses. Press Med. 2010;39:73–84.
-
Kolb M, Bondue B, Pesci A i wsp. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
-
Song JW, Hong S-B, Lim C-M i wsp. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome. Eur Respir J. 2011;37(2):356–363.
-
Song JW, Lee HK, Lee CK i wsp. Clinical course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30(2):103–112.
-
Tomiyama F, Watanabe R, Ishii T i wsp. High Prevalence of Acute Exacerbation of Interstitial Lung Disease in Japanese Patients with Systemic Sclerosis. Tohoku J. Exp. Med. 2016;239, 297–305.
-
Okamoto M, Fujimoto K, Sadohara J i wsp. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54, 445–453.
Materiały dla pacjentów po angielsku