Patofizjologia włókniejącej ILD
Mimo że postacie ILD różnią się między sobą, wspólne są ich szlaki patogenetyczne prowadzące do fibrogenezy1–5

Szlaki patogenetyczne w procesie fibrogenezy1–5
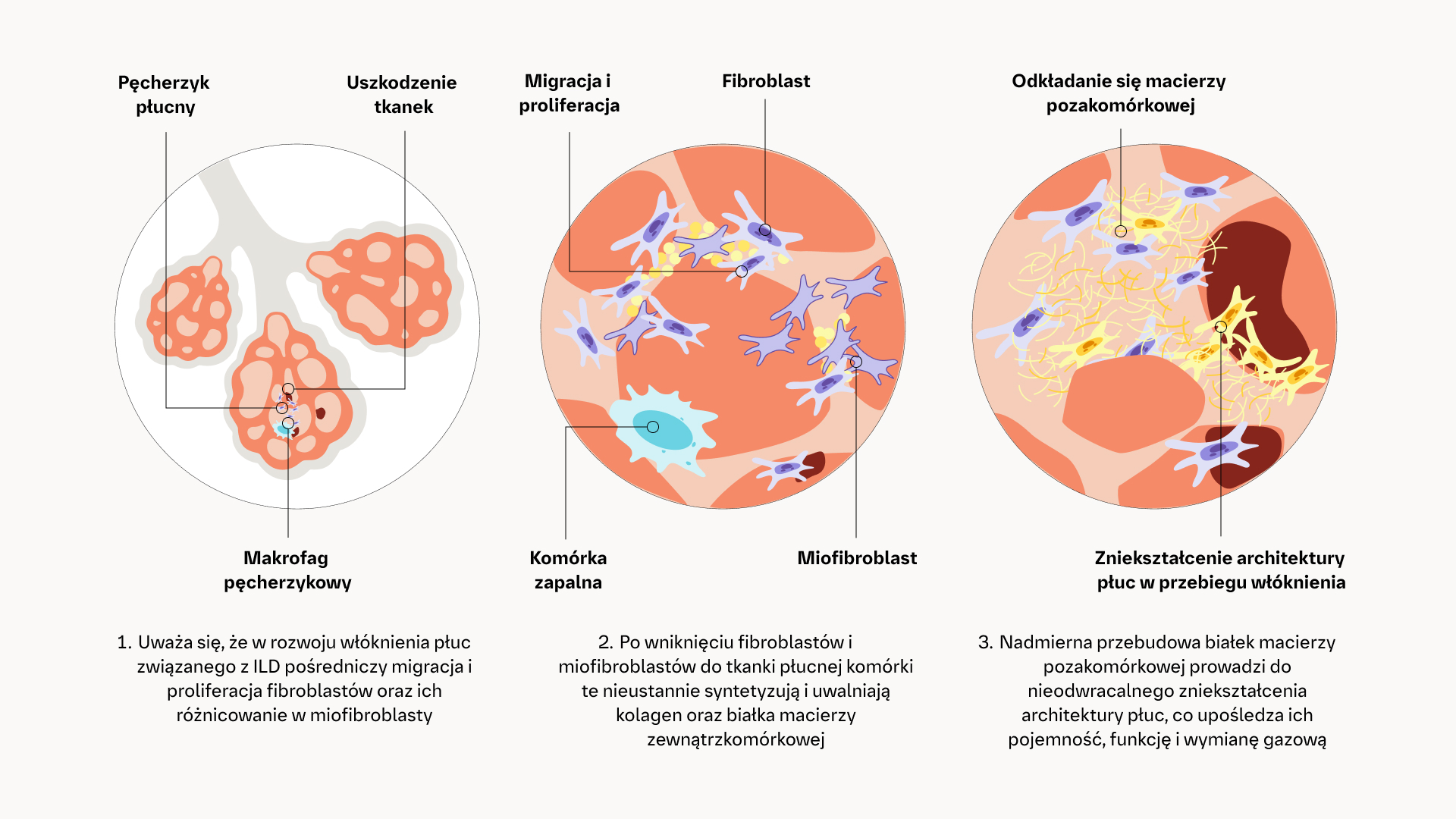
Niezależnie od czynnika wyzwalającego uszkodzenie płuc, postępująca włókniejąca ILD wykazuje podobieństwa nie tylko pod względem przebiegu choroby, ale także mechanizmów patogenetycznych, które prowadzą do włóknienia.3,6
Te mechanizmy patogenetyczne ostatecznie prowadzą do nieodwracalnej utraty integralności bariery nabłonkowej lub śródbłonkowej, zniszczenia architektury płuc oraz utraty ich funkcji.3,6
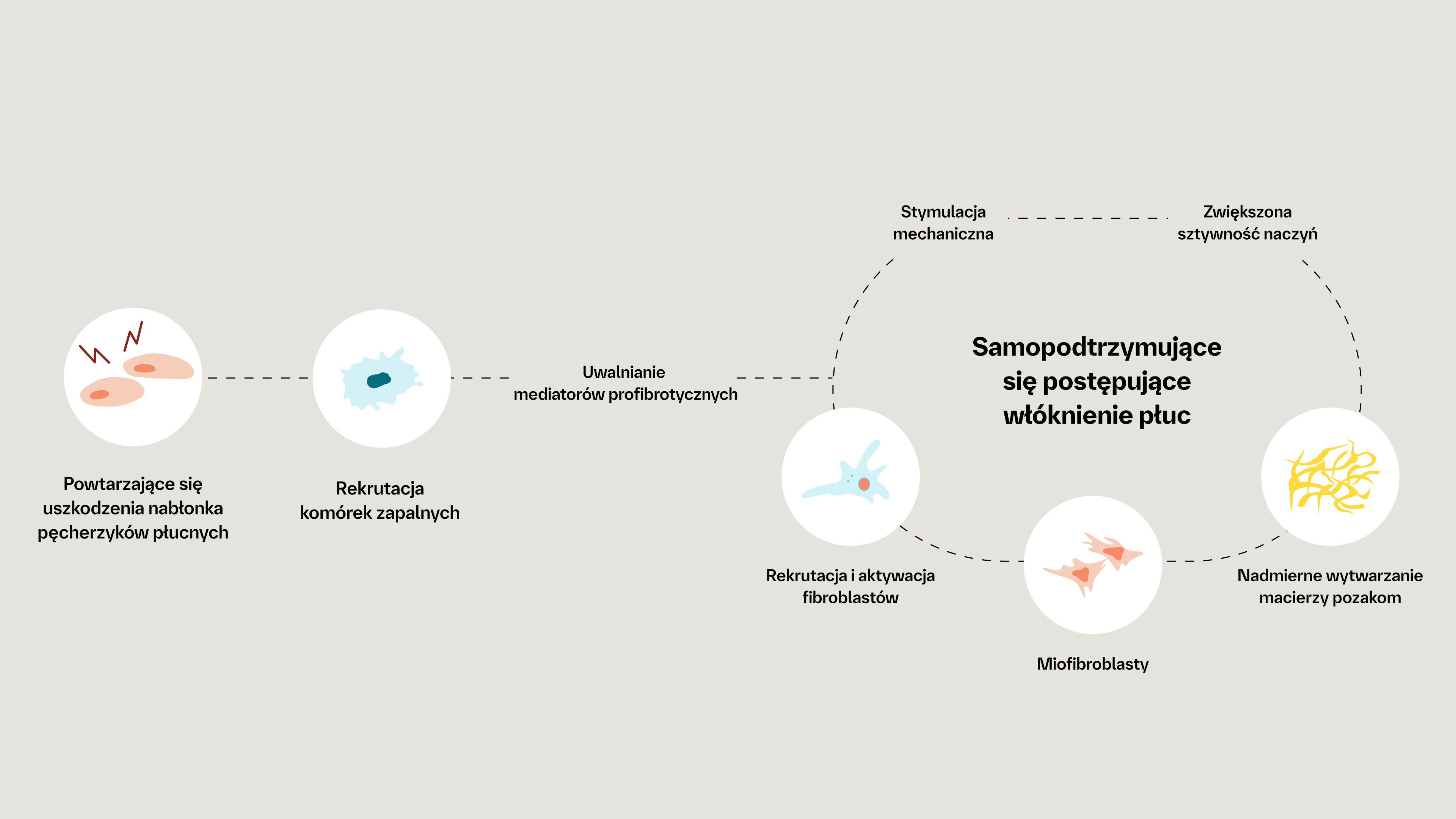
NISZCZĄCE, SAMOPODTRZYMUJĄCE SIĘ SKUTKI POSTĘPUJĄCEJ WŁÓKNIEJĄCEJ ILD
Nadmierne wydzielanie macierzy zewnątrzkomórkowej może prowadzić do samopodtrzymującego się procesu postępującego włóknienia, w którym sztywność tkanek i uwalnianie cytokin profibrotycznych dodatkowo aktywuje fibroblasty.7
Mechanizmy przyczyniające się do samopodtrzymującego się, postępującego włóknienia w postępującej włókniejącej ILD, niezależnie od choroby wyjściowej lub czynnika wyzwalającego8
PROGRESJA MOŻE UTRZYMYWAĆ SIĘ NAWET PO WYELIMINOWANIU CZYNNIKÓW WYZWALAJĄCYCH9,10
U pacjentów z przewlekłym HP może rozwinąć się postępująca choroba włókniejąca pomimo niewystępowania ciągłej ekspozycji na antygen wywołujący.9
W ILD związanej z ekspozycją (np. w krzemicy) progresja objawów i nasilenie choroby mogą występować nawet po ustąpieniu narażenia na czynniki egzogenne.10
WSPÓLNE MECHANIZMY POSTĘPUJĄCEGO WŁÓKNIENIA PŁUC
Poznaj wspólne mechanizmy patofizjologiczne leżące u podstaw fibrogenezy oraz wyjaśnienie samoistnego podtrzymywania się procesu chorobowego we włókniejącej ILD
Interstitial lung disease, or ILD, encompasses a wide variety of chronic lung diseases such as idiopathic pulmonary fibrosis, chronic hypersensitivity pneumonitis, idiopathic nonspecific pulmonary fibrosis, sarcoidosis, ILD associated with connective tissue diseases, such as systemic sclerosis-ILD, inflammatory conditions, such as rheumatoid arthritis, and ILD associated with exposure to occupational or environmental irritants. A proportion of patients with ILD develop a progressive fibrosing phenotype independent from their ILD classification, with a disease course similar to IPF Many of these patients show a restrictive pattern on pulmonary function testing. Their pulmonary fibrosis is driven by an abnormal wound healing response following repeated injury, regardless of the cause of that injury. Mediators released in response to alveolar epithelial and/or vascular endothelial injury include chemokines, endothelin 1, thrombin and numerous growth factors. The abnormal healing response is believed to be due to an imbalance of such mediators, which creates a pro-fibrotic environment. The pro-fibrotic environment drives recruitment, proliferation, activation, and trans-differentiation of resident interstitial fibroblasts into contractile myofibroblasts. Myofibroblasts may also be derived from the trans-differentiation of other cell types, including pericytes, circulating fibrocytes, endothelial and epithelial cells. These myofibroblasts produce excessive extracellular matrix components. The accumulation of these components, combined with collagen cross-linking and contraction, distort the tissue architecture and alter gas exchange. This fibrotic scarring can also lead to occlusion of the local microvasculature, contributing to hypoxia. Once initiated, pulmonary fibrosis can become self-sustaining independent of the original trigger. This happens through multiple feed-forward amplification loops as a result of increased matrix stiffness, tissue pressure, and hypoxia. Pulmonary fibrosis is irreversible, and its progression leads to impaired gas exchange, increasing shortness of breath, a continually reduced quality of life, and ultimately to respiratory failure. Early recognition of pulmonary fibrosis is vital, given the significant morbidity and mortality associated with progressive fibrosing ILD.
Jak można rozpoznać fenotyp progresywny u pacjentów z włókniejącą ILD?
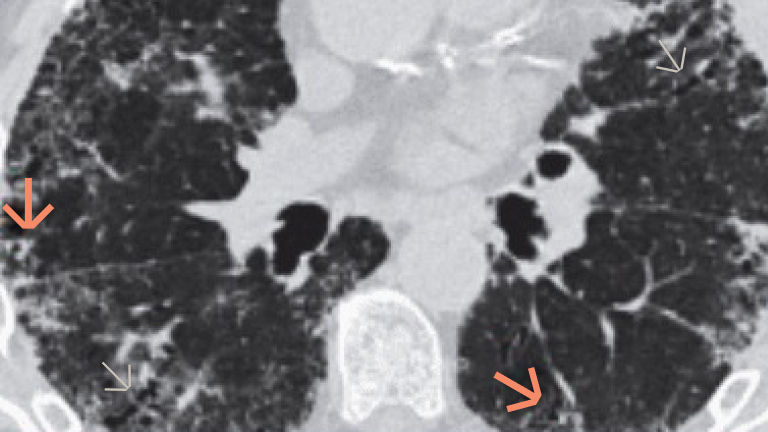
Badanie włókniejącej ILD za pomocą obrazowania HRCT

Wczesne i regularne monitorowanie
Rozpoznanie ILD
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Selman M, King TE, Pardo A i wsp. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
-
Wuyts WA, Agostini C, Antoniou KM i wsp. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
-
Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
-
Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Maher TM, Wuyts W. Management of fibrosing interstitial lung diseases. Adv Ther. 2019;36(7):1518–1531.
-
Fischer A and Distler J. Progressive fibrosing interstitial lung disease associated with systemic autoimmune diseases. Clin Rheumatol. 2019;38(10):2673–2681.
-
Wollin L, Distler JHW, Redente EF i wsp. Potential of nintedanib in treatment of progressive fibrosing interstitial lung diseases. Eur Respir J. 2019;54(3):1900161. doi: 10.1183/13993003.00161-2019.
-
Fernández Pérez ER, Swigris JJ, Forssén AV i wsp. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest. 2013;144(5):1644–1651.
-
Khalil N, Churg A, Muller N, O’Connor R. Environmental, inhaled and ingested causes of pulmonary fibrosis. Toxicol Pathol. 2007;35(1):86-96.
-
Brauner M i wsp. Imagerie des pneumopathies infiltrantes diffuses. Press Med. 2010;39:73–84.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Theodore AC, Tseng C-H, Li N, Elashoff RM, Tashkin DP. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the Scleroderma Lung Study. Chest. 2012;142(3):614–621.
-
Hoffmann-Vold AM, Fretheim H, Halse AK i wsp. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.
-
Hoffmann-Vold AM, Maher TM, Philpot EE i wsp. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2: e71–e83.
-
Asano Y, Jinnin M, Kawaguchi Y i wsp. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45, 633–691.
Materiały dla pacjentów po angielsku




