Czynniki ryzyka progresji ILD
U pewnego odsetka pacjentów z ILD typu innego niż IPF może rozwinąć się postępujące włóknienie płuc1–4

Fenotyp postępującego włóknienia charakteryzuje się zwiększoną rozległością włóknienia, bardziej nasilonymi objawami oddechowymi oraz pogorszeniem czynności płuc2–5
KTÓRE CZYNNIKI ZWIĘKSZAJĄ RYZYKO PROGRESJI ILD U PACJENTÓW Z ILD TYPU INNEGO NIŻ IPF?
Pacjenci z rozległym włóknieniem płuc są najbardziej narażeni na ryzyko progresji ILD6
Możliwe do uogólnienia czynniki ryzyka progresji ILD6
| HRCT | Obraz UIP |
| Rozległe trakcyjne rozstrzenie oskrzeli | |
| Odpowiedź na leczenie | Brak regresji lub stabilizacji choroby po zastosowaniu leczenia początkowego |
| Inne stany medyczne | Zespół krótkiego telomeru |
| Wiek | Osoby starsze |
U pacjentów starszych z włóknieniem płuc typu UIP w badaniu HRCT najczęściej dochodzi do pogorszenia6
CZYNNIKI RYZYKA PROGRESJI ILD TYPU INNEGO NIŻ IPF
ZAPALENIE PŁUC WYNIKAJĄCE Z NADWRAŻLIWOŚCI (HP)
U pacjentów z HP czynniki ryzyka związane z progresją ILD lub nagłym zaostrzeniem ILD obejmują identyfikację antygenu, włóknienie w obrazie HRCT, % wartości należnej DLCO, nadciśnienie płucne oraz obecność KL‑6, YKL‑40 i CCL17 w surowicy7
Ciągła ekspozycja na antygen wywołujący powoduje progresję choroby i rozwój włóknienia w HP8
IU pacjentów z cHP brak możliwości identyfikacji antygenu wywołującego stanowi istotny czynnik predykcyjny krótszego czasu przeżycia9
U pacjentów z HP należy przeprowadzić badania przesiewowe w kierunku antygenu wywołującego, aby go zidentyfikować i wyeliminować9
Wszystkich pacjentów z HP należy zachęcać do unikania potencjalnych źródeł ekspozycji na antygen9
Rodzaj oraz ilość wdychanego antygenu, intensywność i częstotliwość ekspozycji, kofaktory środowiskowe oraz interakcja istotnych antygenów z odpowiedzią immunologiczną mogą wpływać na rozwój i progresję HP7
SAMOISTNE NIESWOISTE ŚRÓDMIĄŻSZOWE ZAPALENIE PŁUC (iNSIP)
U pacjentów z iNSIP płeć męska, początkowa TLC, spadek FVC po 3 miesiącach i obecność zmian typu „plastra miodu” w badaniu HRCT są czynnikami predykcyjnymi postępującego pogorszenia.10
CHOROBA ŚRÓDMIĄŻSZOWA PŁUC W PRZEBIEGU CHOROBY TKANKI ŁĄCZNEJ (CTD‑ILD)
Czynniki ryzyka progresji ILD w CTD‑ILD11–21 | |
| RZS‑ILD | |
| SSc-ILD | |
W jaki sposób można monitorować i prowadzić pacjentów, u których istnieje ryzyko progresji ILD?

Wczesne i regularne monitorowanie
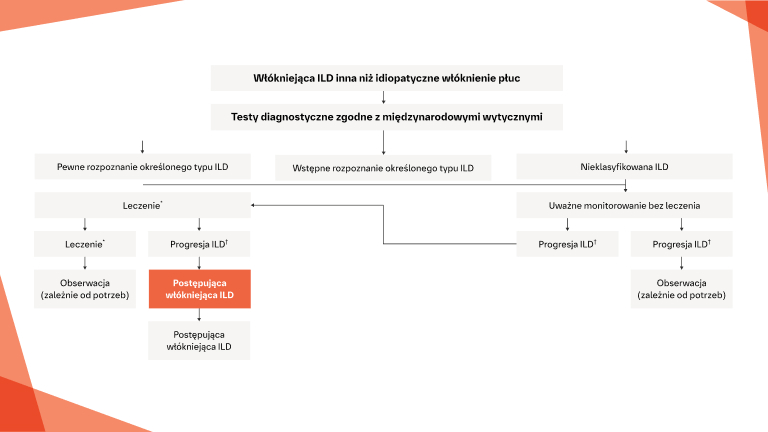
Interwencje w ILD
-
Wijsenbeek M, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Flaherty KR i wsp. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212.
-
George PM, Spagnolo P, Kreuter M i wsp. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
-
Costabel U, Miyazaki Y, Pardo A i wsp. Hypersensitivity pneumonitis. Nat Rev Dis Primers. 2020;6:65.
-
Varone F, Iovene B, Sgalla G i wsp. Fibrotic Hypersensitivity Pneumonitis: Diagnosis and Management. Lung. 2020; https://doi.org/10.1007/s00408-020-00360-3.
-
Fernandez Perez ER, Swigris JJ, Forssen AV i wsp. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest. 2013;144:1644–1651.
-
Park IN, Jegal Y, Kim DS i wsp. Clinical course and lung function change of idiopathic nonspecific interstitial pneumonia. Eur Respir J. 2009;33:68–76.
-
Dawson JK, Fewins HE, Desmond J i wsp. Predictors of progression of HRCT diagnosed fibrosing alveolitis in patients with rheumatoid arthritis. Ann Rheum Dis. 2002;61:517–521.
-
Kawano-Dourado L, Doyle TJ, Bonfiglioli K i wsp. Baseline characteristics and progression of a spectrum of interstitial lung abnormalities and disease in rheumatoid arthritis. Chest. 2020:S0012-3692(20)31412-4. doi: 10.1016/j.chest.2020.04.061.
-
Zamora-Legoff JA, Krause ML, Crowson CS i wsp. Progressive decline of lung function in rheumatoid arthritis associated interstitial lung disease. Arthritis Rheumatol. 2017;69(3):542–549.
-
Esposito AJ, Chu SG, Madan R i wsp. Thoracic manifestations of rheumatoid arthritis. Clin Chest Med. 2019;40(3):545–560.
-
Avouac J, Cauvet A, Steelandt A i wsp. Improving risk-stratification of rheumatoid arthritis patients for interstitial lung disease. PLoS One. 2020;15(5):e0232978. doi:10.1371/journal.pone.0232978.
-
Winstone TA, Assayag D, Wilcox PG i wsp. Predictors of mortality and progression in scleroderma-associated interstitial lung disease: a systematic review. Chest. 2014;146:422–436.
-
Cappelli S, Bellando Randone S, Camiciottoli G i wsp. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24:411–419.
-
Nihtyanova SI, Schreiber BE, Ong VH i wsp. Prediction of pulmonary complications and long-term survival in systemic sclerosis. Arthritis Rheumatol. 2014;66: 1625-1635.
-
Hoffmann-Vold AM, Allanore Y, Alves M i wsp. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020;217455.
-
Wu W, Jordan S, Becker MO i wsp. Prediction of progression of interstitial lung disease in patients with systemic sclerosis: the SPAR model. Ann Rheum Dis. 2018;77:1326–1332.
-
Volkmann, Elizabeth R, Tashkin DP i wsp. Progression of interstitial lung disease in systemic sclerosis: the importance of pneumoproteins Krebs von den Lungen 6 and CCL18. Arthritis Rheumatol. 2019b;71:2059–2067.
-
Maher TM, Molina-Molina M, Russell AM i wsp. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Robalo-Cordeiro C, Campos P, Carvalho L i wsp. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
Materiały dla pacjentów po angielsku




