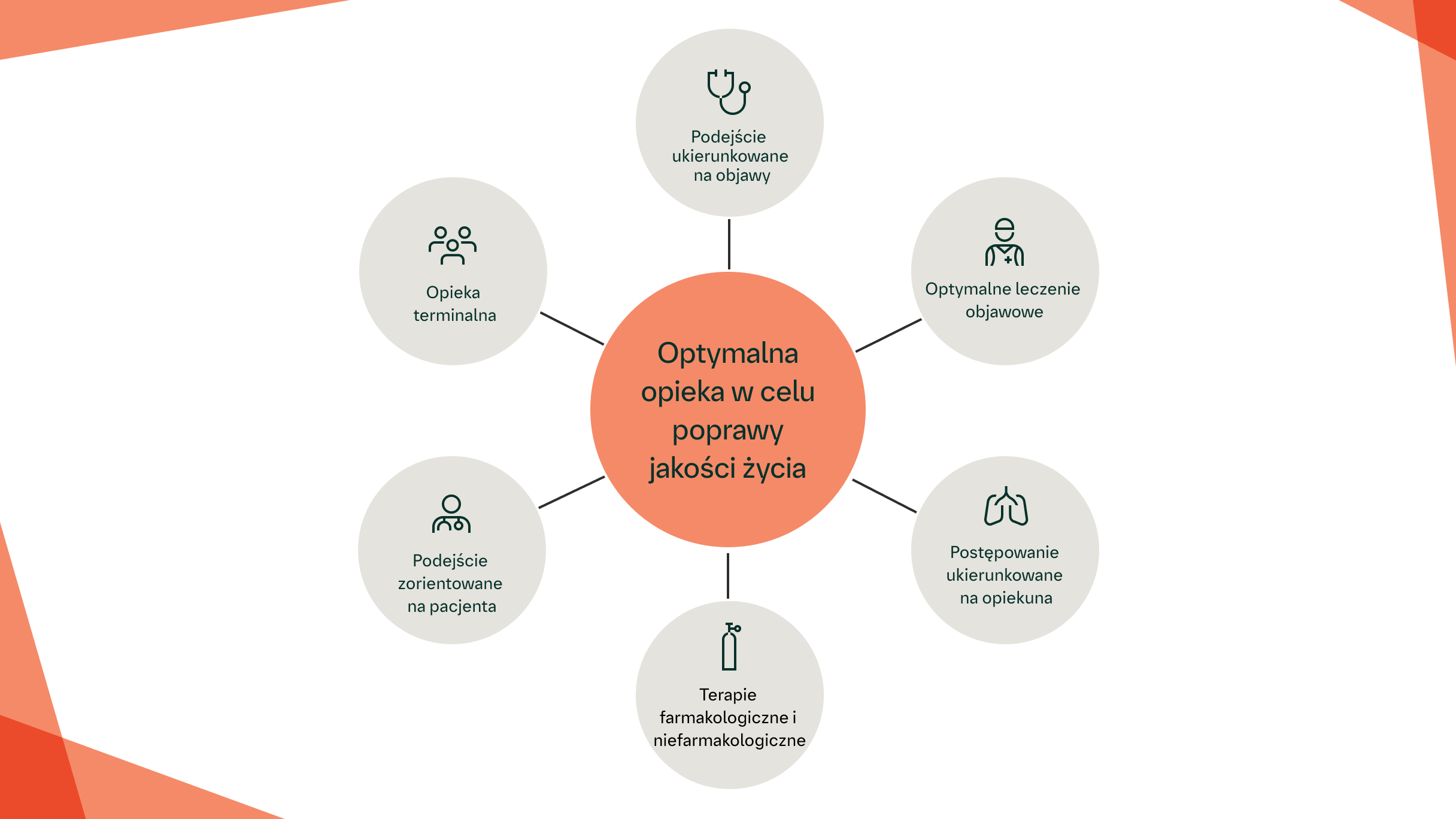
Opieka paliatywna/ wspomagająca w ILD
Podjęcie działań w zakresie opieki paliatywnej/wspomagającej przynosi korzyści pacjentom z włóknieniem płuc1,2

Dostępna jest szeroka gama metod wspierania pacjentów z ILD – od rehabilitacji pulmonologicznej po techniki medytacji „mindfulness”1–4
Potrzeby pacjentów z postępującą włókniejącą ILD są podobne do potrzeb pacjentów z chorobą nowotworową.2
Pacjenci z ILD potrzebują szybkiej diagnozy, wyczerpujących informacji, wczesnego dostępu do leczenia oraz holistycznej opieki2
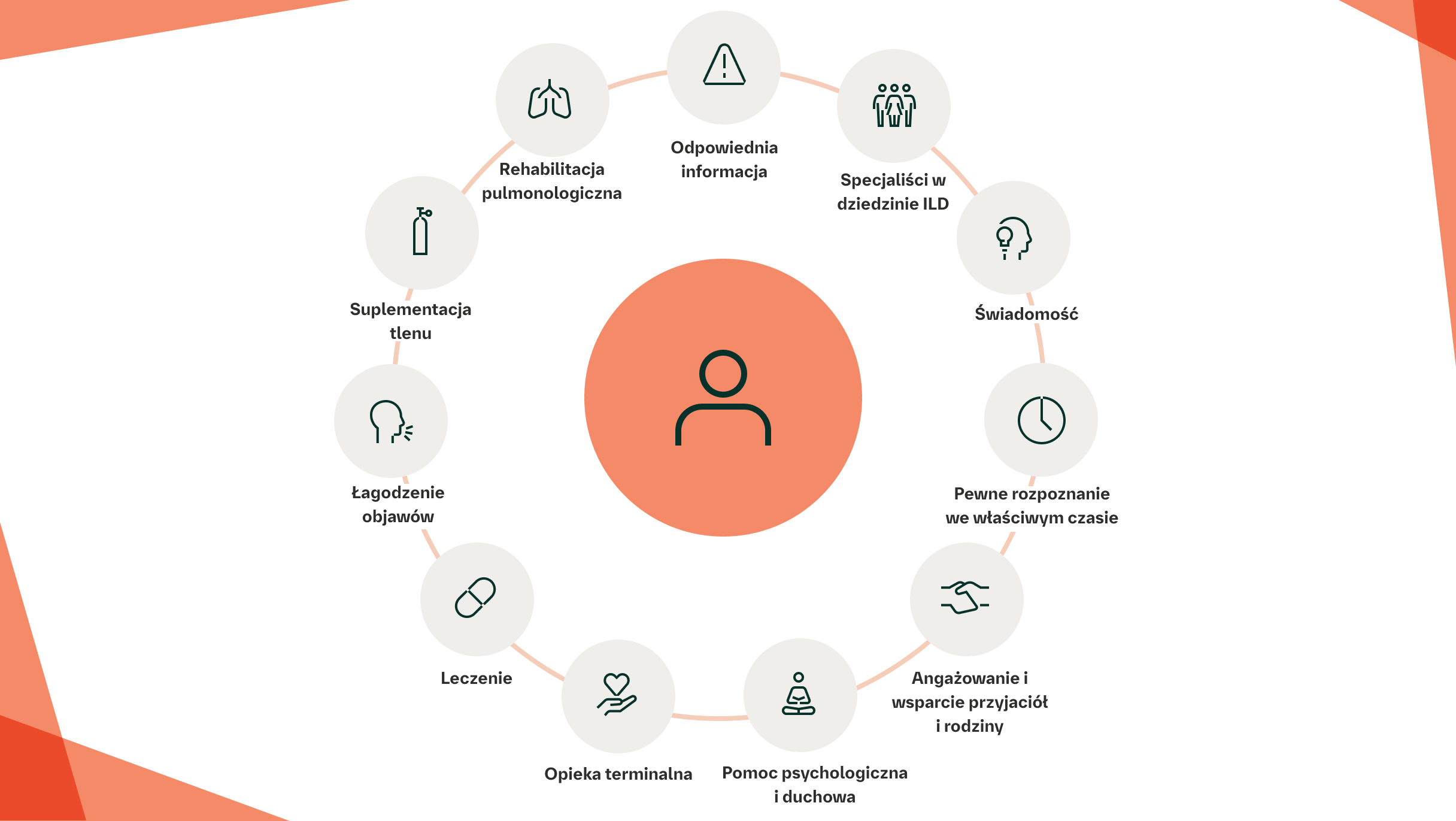
Holistyczna opieka mająca na celu optymalizację jakości życia powinna obejmować:2
Opiekę mającą na celu stabilizację choroby, w tym zarówno terapie farmakologiczne, jak i niefarmakologiczne, włączając leczenie chorób współistniejących
Postępowanie ukierunkowane na objawy obniżające jakość życia, w tym takie jak depresja, lęk, uczucie zmęczenia i utrata kondycji
Postępowanie ukierunkowane na pacjenta i opiekuna, takie jak edukacja i pomoc w samodzielnym radzeniu sobie z chorobą
Strategie związane z opieką terminalną, takie jak planowanie opieki z wyprzedzeniem
Opieka holistyczna powinna mieć na celu optymalizację jakości życia na każdym etapie ILD2†
REHABILITACJA PULMONOLOGICZNA MOŻE ISTOTNIE POPRAWIAĆ WYDOLNOŚĆ CZYNNOŚCIOWĄ ORAZ JAKOŚĆ ŻYCIA U PACJENTÓW Z WŁÓKNIEJĄCĄ ILD:1




Rehabilitacja pulmonologiczna istotnie poprawia jakość życia, zmniejsza duszność i depresję u pacjentów z włókniejącą ILD1
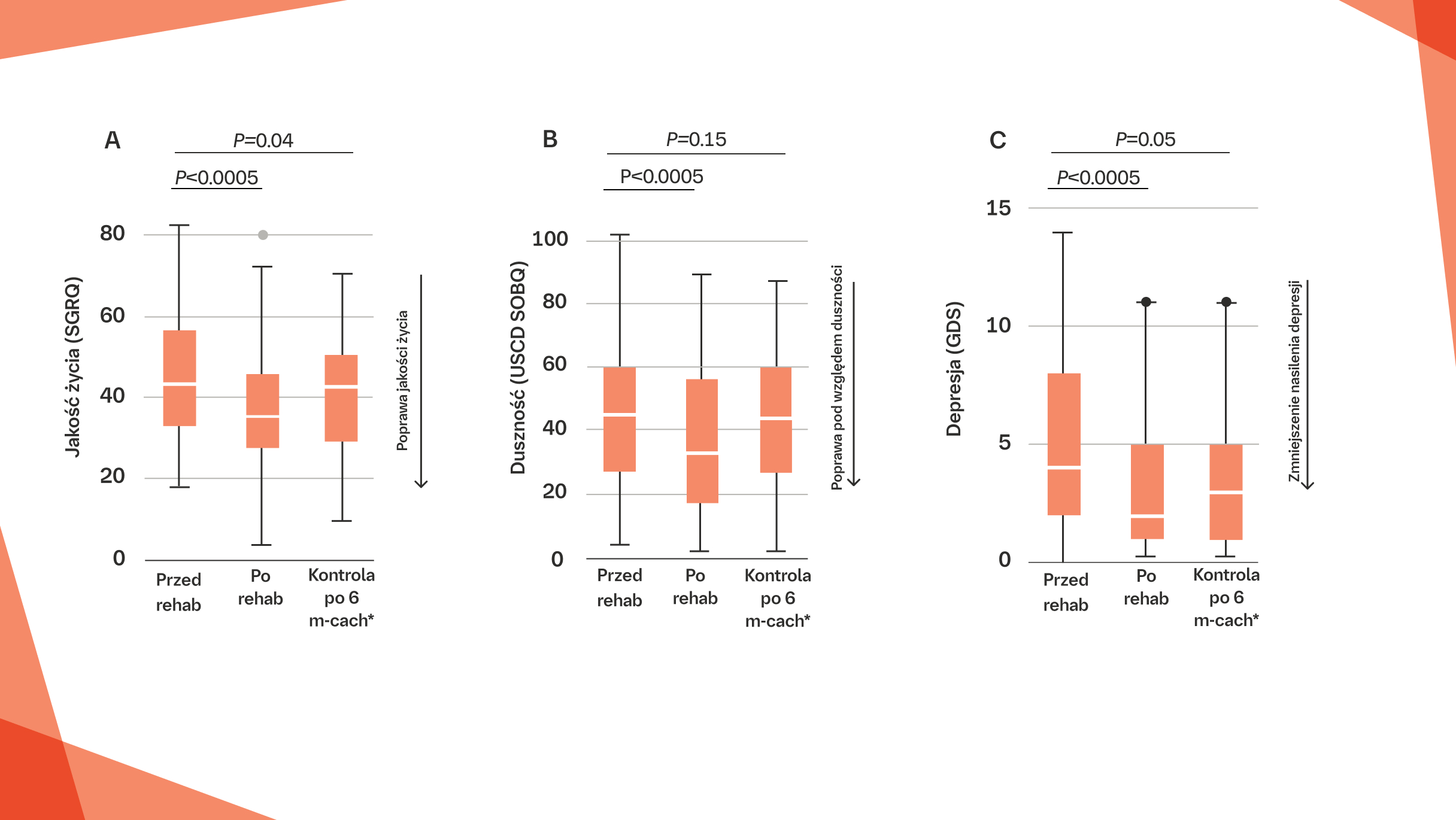
Wykresy pudełkowe dla (A) jakości życia, (B) duszności i (C) depresji, porównujące wartości przed rehabilitacją pulmonologiczną z wartościami po rehabilitacji pulmonologicznej oraz po 6‑miesięcznej obserwacji.
* Dane dotyczące kontroli po 6 miesiącach odnoszą się do pomiarów wykonanych sześć miesięcy po rozpoczęciu rehabilitacji pulmonologicznej.
SUPLEMENTACJA TLENU PODCZAS RUTYNOWYCH CODZIENNYCH CZYNNOŚCI POPRAWIA JAKOŚĆ ŻYCIA PACJENTÓW Z POSTĘPUJĄCĄ WŁÓKNIEJĄCĄ ILD2
DUSZNOŚĆ I AMBULATORYJNA SUPLEMENTACJA TLENU
U pacjentów z postępującą włókniejącą ILD z izolowaną hipoksją wysiłkową odnotowano istotne zmniejszenie nasilenia duszności po 2 tygodniach ambulatoryjnej suplementacji tlenu w porównaniu z niestosowaniem takiego leczenia (p<0,0001)6
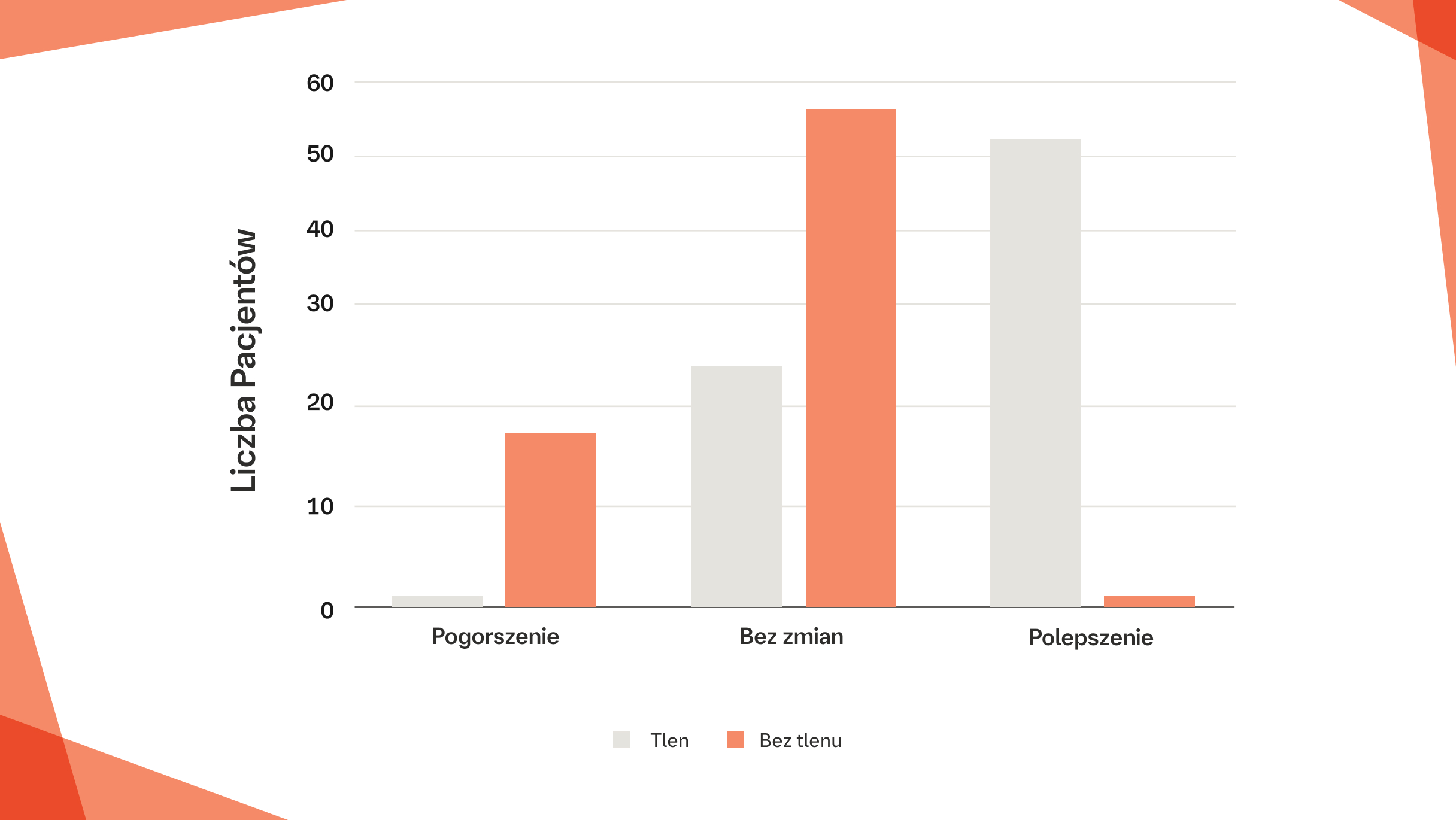
Liczba pacjentów zgłaszających poprawę, stan bez zmian lub pogorszenie pod względem duszności po dwóch tygodniach ambulatoryjnej suplementacji tlenu bądź niestosowania tlenu.
JAKOŚĆ ŻYCIA I AMBULATORYJNA SUPLEMENTACJA TLENU
Ambulatoryjna suplementacja tlenu była związana z istotną poprawą łącznego wyniku w skali K‑BILD w porównaniu z niestosowaniem tlenu u pacjentów z postępującą włókniejącą ILD z izolowaną hipoksją wysiłkową6
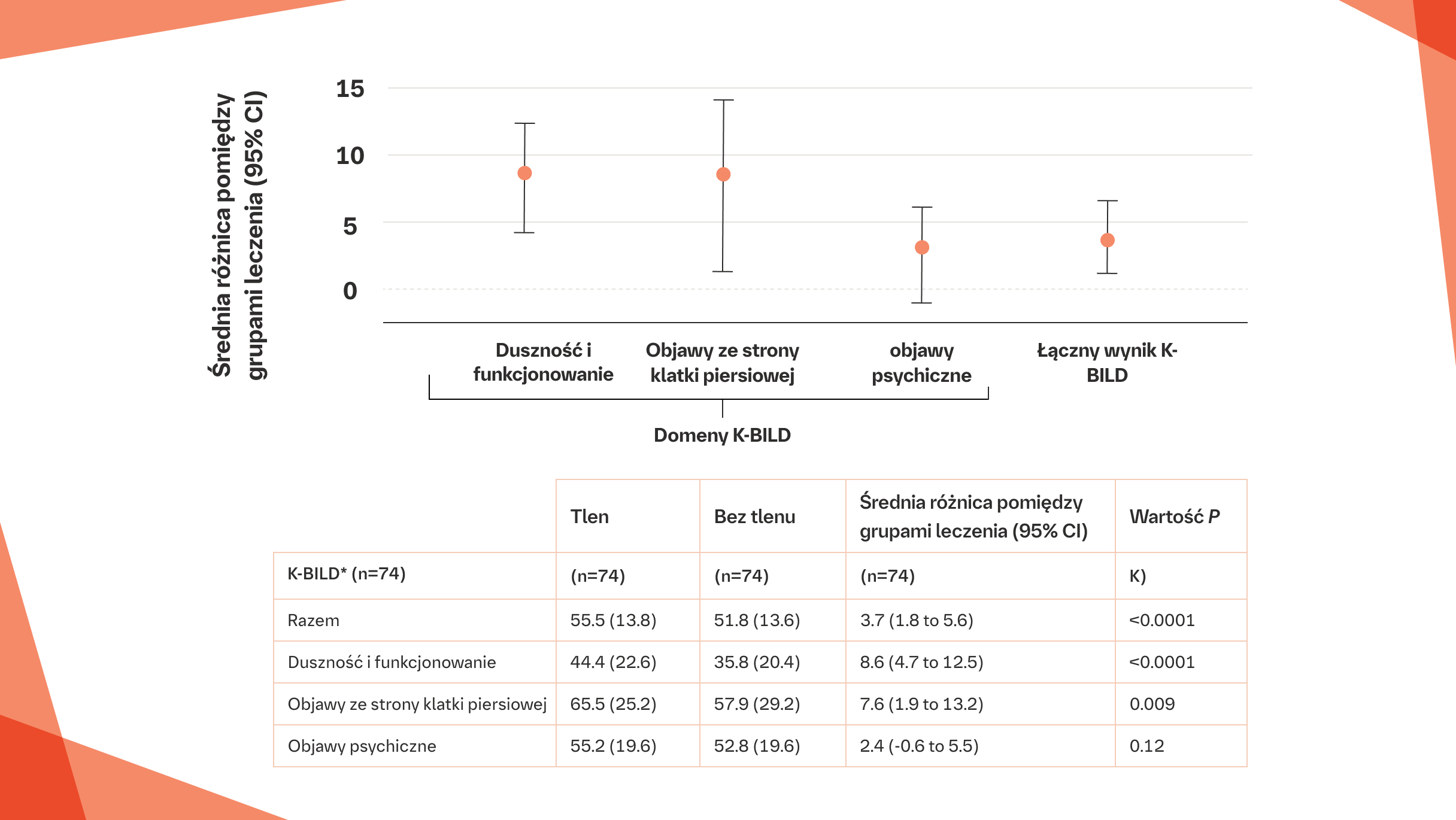
Średnia różnica wyników w skali K‑BILD pomiędzy ambulatoryjną suplementacją tlenu a niestosowaniem leczenia, skorygowana o kolejność leczenia. Ambulatoryjne stosowanie tlenu podczas wykonywania codziennych czynności przez 2 tygodnie było związane z istotną poprawą łącznego wyniku w skali K‑BILD w porównaniu z niestosowaniem tlenu [55,5 (SD 13,8) w przypadku stosowania tlenu w porównaniu z 51,8 (SD 13,6) bez stosowania tlenu; p<0,0001].
* Wyższe wyniki oznaczają lepszą jakość życia; minimalna klinicznie istotna różnica wyniku w skali K‑BILD wynosi 4 (zakres: 3,7–4,2) dla łącznego wyniku, 6 (5,6–6,5) dla podskali duszności i funkcjonowania, 5,4 (4,6–6,9) dla podskali objawów psychologicznych oraz 0,5 (SD 8,9) dla podskali objawów ze strony klatki piersiowej.
PROGRAM WSPARCIA DLA PACJENTÓW Z IPF ORAZ ICH PARTNERÓW (PPEPP)
PPEPP to krótki, wielodyscyplinarny programem wsparcia, który opracowano wspólnie z pacjentami i ekspertami z różnych dziedzin.7 Program PPEPP obejmuje angażowanie pacjenta z IPF i jego partnera (współmałżonka, partnera, krewnego lub przyjaciela) w niewielkich grupach, które stymulują interakcje osobiste, indywidualnie dostosowaną dyskusję oraz równoważą udział w interwencji dla pacjenta
Wykazano, że program PPEPP, obejmujący angażowanie w niewielkich grupach, poprawia jakość życia pacjentów z IPF oraz ich partnerów2
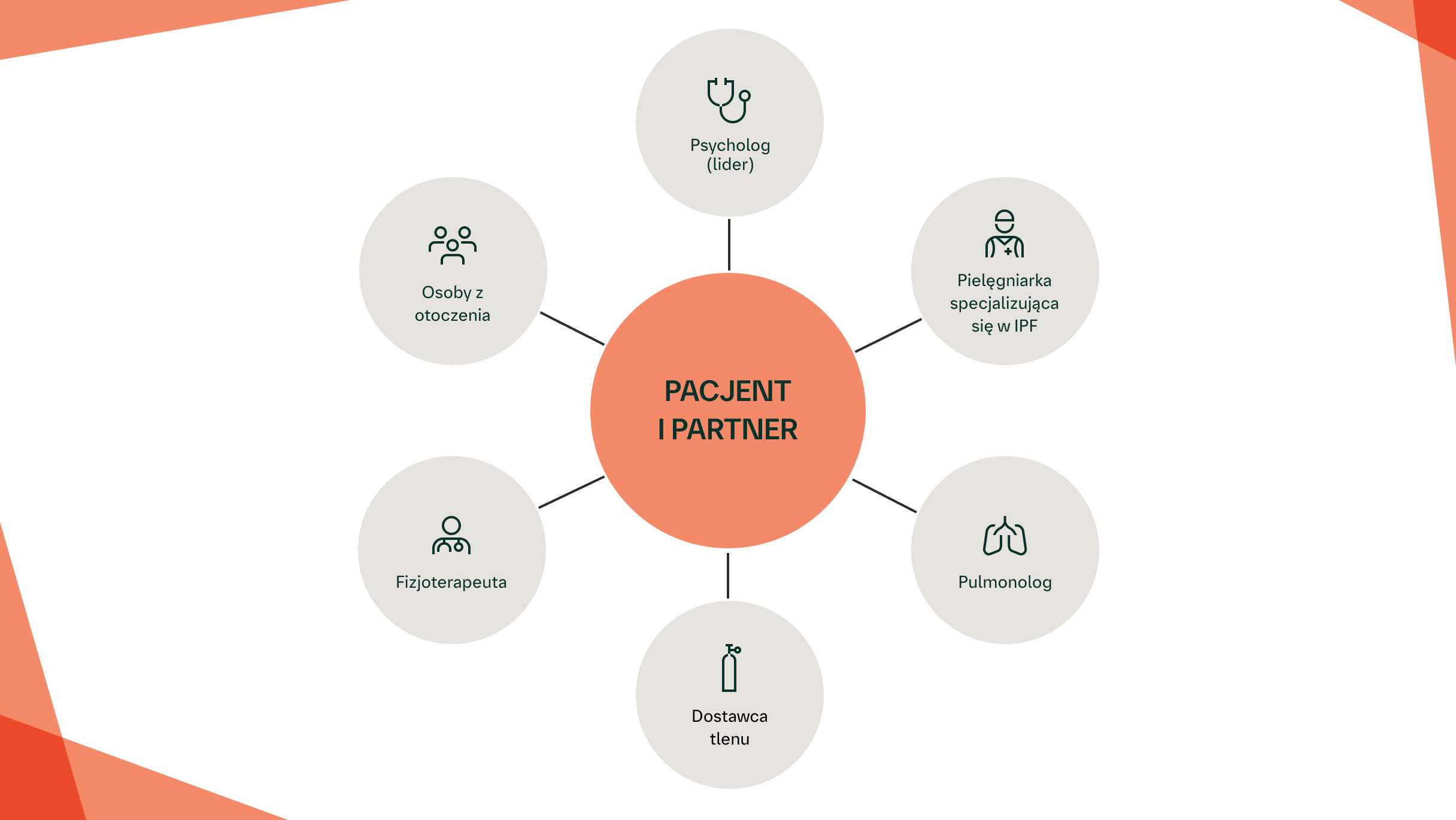
Wykazano, że program PPEPP zmniejsza stres i ma pozytywny wpływ na samopoczucie pacjentów z IPF oraz ich partnerów,7 wskazując, że potencjalnie niepokojące informacje powinny być starannie dostosowane do pacjentów oraz ich partnerów.
WCZESNA OPIEKA PALIATYWNA MOŻE POMÓC W UTRZYMANIU DOBREGO SAMOPOCZUCIA FIZYCZNEGO I EMOCJONALNEGO U PACJENTÓW Z POSTĘPUJĄCĄ WŁÓKNIEJĄCĄ ILD2
Niemal połowa pacjentów z postępującą włókniejącą ILD umiera w szpitalu z powodu niewłaściwego planowania opieki nad chorym.8 W związku z tym warto oferować wszystkim pacjentom z postępującą włókniejącą ILD planowanie opieki z wyprzedzeniem, w tym omówienie ograniczeń w leczeniu oraz preferencje dotyczące końcowego okresu życia u wszystkich pacjentów z postępującą włókniejącą ILD.2
Opieka paliatywna jest czasem błędnie postrzegana jako obejmująca wyłącznie opiekę u schyłku życia, co może wyjaśniać niedostateczne wykorzystywanie wiedzy specjalistycznej z zakresu opieki paliatywnej nad chorymi na włókniejącą ILD.2 Opieka paliatywna odgrywa cenną rolę na wcześniejszym etapie przebiegu ILD – według coraz szerszego konsensusu opiekę paliatywną w ILD należy rozpoczynać wcześnie, a nie zwlekać z nią aż do momentu, gdy ILD będzie w stadium zaawansowanym, co może pomóc uniknąć błędnego przekonania, że opieka paliatywna jest równoznaczna ze zbliżającym się zgonem.2 Strategia postępowania oparta na przebiegu ILD może być pomocna w identyfikacji potrzeb chorych w zakresie opieki paliatywnej ze względu na nieprzewidywalny przebieg większości przypadków włókniejącej ILD.2
Wykazano, że opieka paliatywna obejmująca leczenie farmakologiczne uzupełnione postępowaniem niefarmakologicznym poprawia jakość życia związaną z objawami.2 Wczesna opieka paliatywna powinna być wdrażana u pacjentów, u których ILD przybiera charakter postępujący pomimo optymalnego postępowania medycznego, gdy pacjent odczuwa jawny niepokój lub gdy objawy są uciążliwe.2 Poprawa opieki paliatywnej nad pacjentami z postępującą włókniejącą ILD prawdopodobnie może zmniejszać obciążenie związane z objawami.
JAKIE SĄ POTRZEBY PACJENTÓW Z ILD ZWIĄZANE Z OPIEKĄ PALIATYWNĄ?
Algorytm oparty na przebiegu ILD, pomagający klinicystom ocenić bezpośrednią potrzebę opieki paliatywnej u pacjentów z włókniejącą ILD2
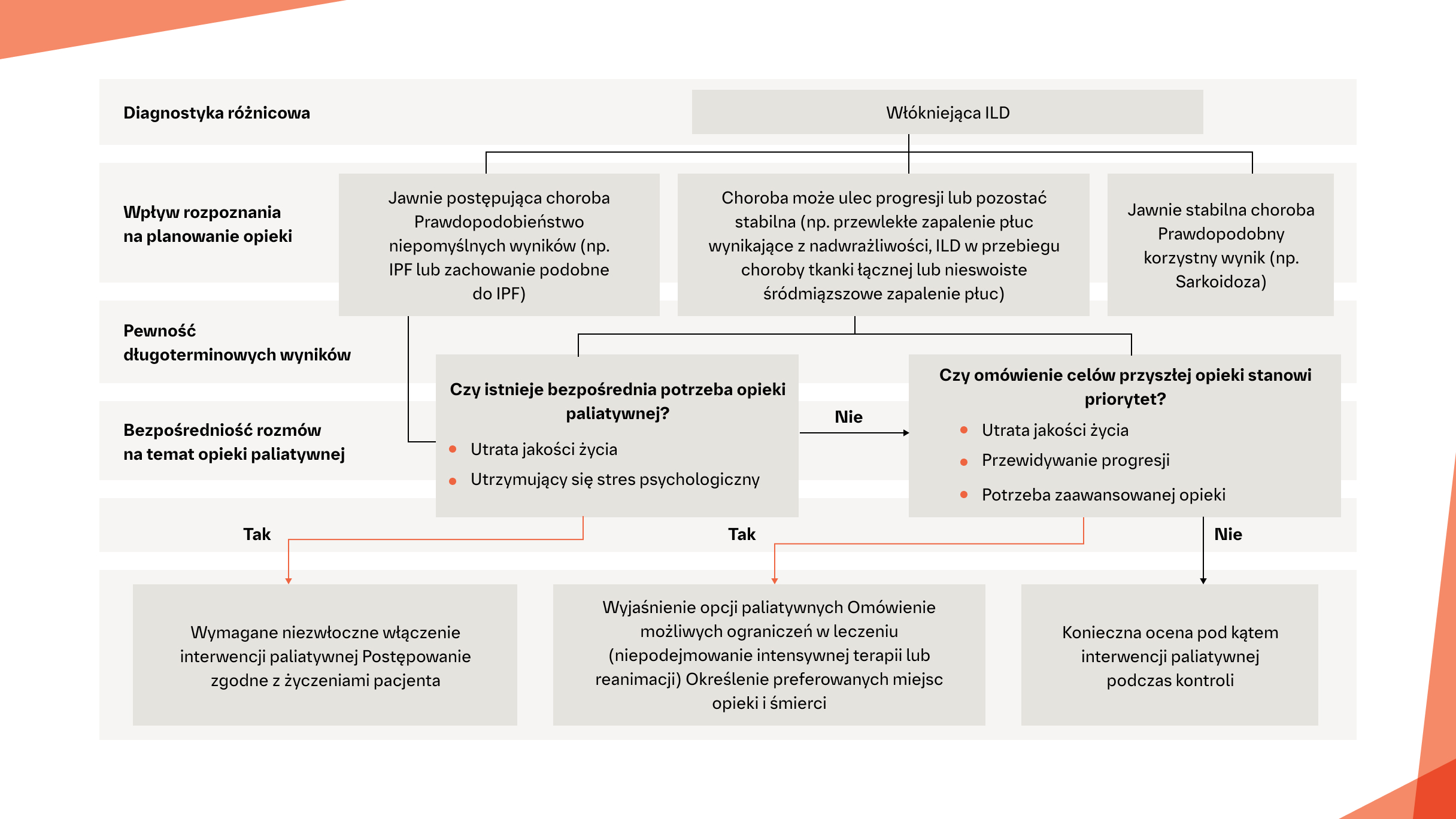
Opieka paliatywna powinna być zapewniona w całym przebiegu ILD u pacjentów z włókniejącą ILD2
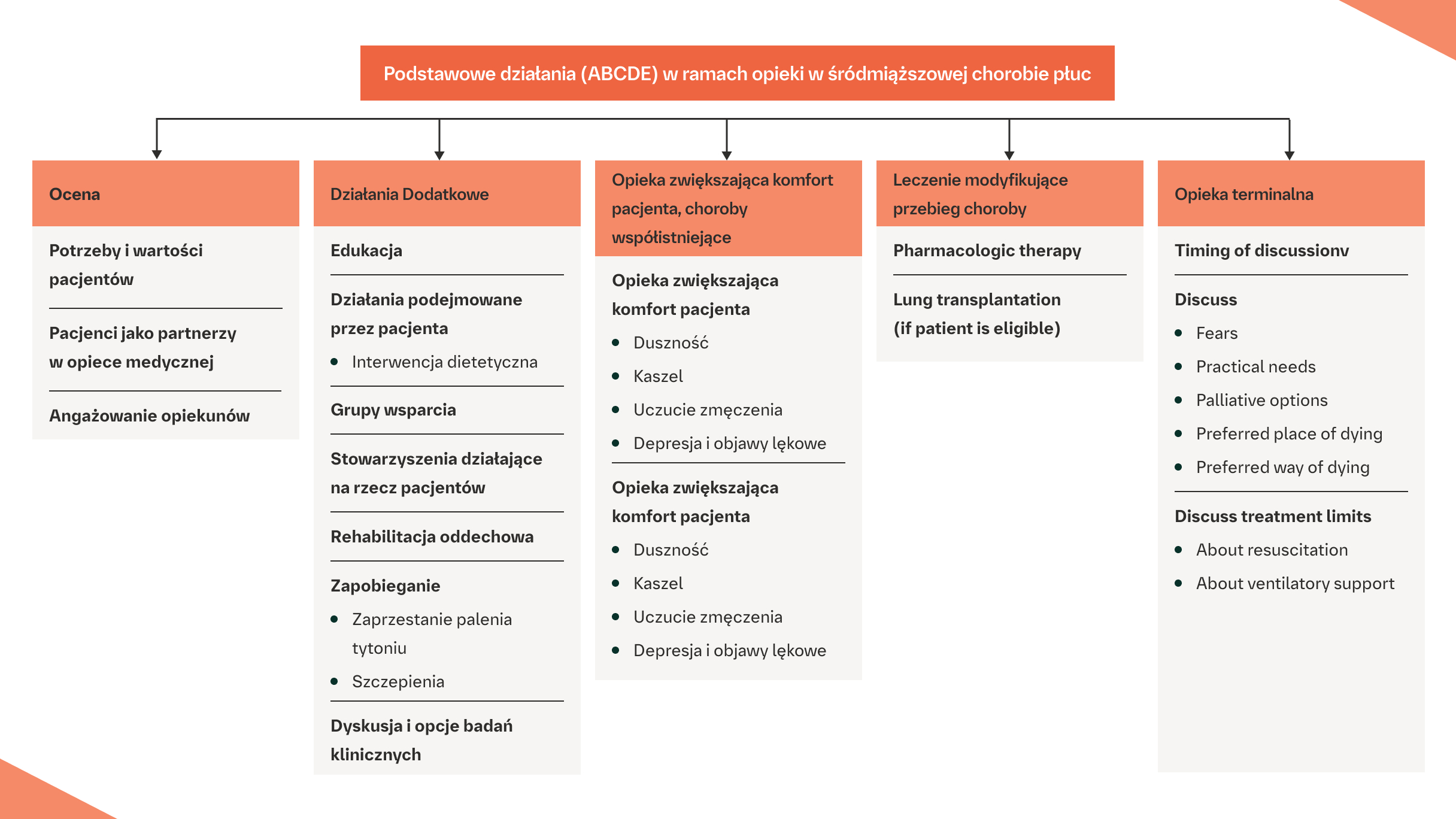
Model ABCDE przedstawia możliwe ustrukturyzowane podejście do kompleksowej opieki, w tym opieki paliatywnej, w całym przebiegu ILD.
* Leki o działaniu antyfibrotycznym są dopuszczone do stosowania wyłącznie w IPF.
† ILD typu innego niż IPF.
Jak identyfikować u pacjentów ILD możliwie jak najwcześniej i jakie postępowanie należy podejmować?
Rozpoznanie ILD

Zespoły wielodyscyplinarne
Przypisy
-
*
Liczby oparte na prospektywnym badaniu kohortowym.
-
Ryerson CJ, Cayou C, Topp F i wsp. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203–210.
-
Kreuter M, Bendstrup E, Russell A i wsp. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968–980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [publikacja elektroniczna przed drukiem].
-
Sgalla G, Cerri S, Ferrari R i wsp. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Visca D, Mori L, Tsipouri V i wsp. Effect of ambulatory oxygen on quality of life for patients with fibrotic lung disease (AmbOx): a prospective, open-label, mixed-method, crossover randomised controlled trial. Lancet Respir Med. 2018;6(10):759–770.
-
van Manen M, Kreuter M, van den Blink B i wsp. What patients with pulmonary fibrosis and their partners think: a live, educative survey in the Netherlands and Germany. ERJ Open Res. 2017;3(1):00065-2016.
-
Ahmadi Z, Wysham N, Lundstrom S i wsp. End-of-life care in oxygen-dependent ILD compared with lung cancer: a national population-based study. Thorax. 2016;71(6):510–516.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Theodore AC, Tseng C-H, Li N, Elashoff RM, Tashkin DP. Correlation of cough with disease activity and treatment with cyclophosphamide in scleroderma interstitial lung disease: findings from the Scleroderma Lung Study. Chest. 2012;142(3):614–621.
-
Hoffmann-Vold AM, Fretheim H, Halse AK i wsp. Tracking impact of interstitial lung disease in systemic sclerosis in a complete nationwide cohort. Am J Respir Crit Care Med. 2019;200:1258–1266.
-
Hoffmann-Vold AM, Maher TM, Philpot EE i wsp. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2:e71–e83.
-
Asano Y, Jinnin M, Kawaguchi Y i wsp. Diagnostic criteria, severity classification and guidelines of systemic sclerosis: Guideline of SSc. J Dermatol. 2018;45:633–691.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
Materiały dla pacjentów po angielsku




