Monitorowanie pod kątem progresji ILD
Nasilenie objawów lub pogorszenie wyników PFT może oznaczać, że włóknienie płuc u pacjenta postępuje1

U pewnego odsetka pacjentów z ILD może rozwinąć się fenotyp postępującego włóknienia.2–5
Po wykluczeniu i wyleczeniu przyczyn alternatywnych, takich jak zakażenie dróg oddechowych, można uznać, że postępujące włóknienie występuje u pacjentów z ILD, u których w ciągu 24 miesięcy pomimo leczenia w praktyce klinicznej spełnione zostały następujące kryteria:6
Względny spadek FVC o ≥10%
Względny spadek FVC o ≥5–<10% i względny spadek DL∞ o ≥15%
Względny spadek FVC o ≥5–<10% i nasilenie objawów oddechowych
Względny spadek FVC o ≥5–<10% i zwiększona rozległość włóknienia w badaniu HRCT
Nasilenie objawów ze strony układu oddechowego i zwiększona rozległość włóknienia w badaniu HRCT


Postępująca włókniejąca ILD charakteryzuje się progresją włóknienia płuc, nasileniem objawów, pogorszeniem czynności płuc i obniżeniem jakości życia związanej ze zdrowiem4
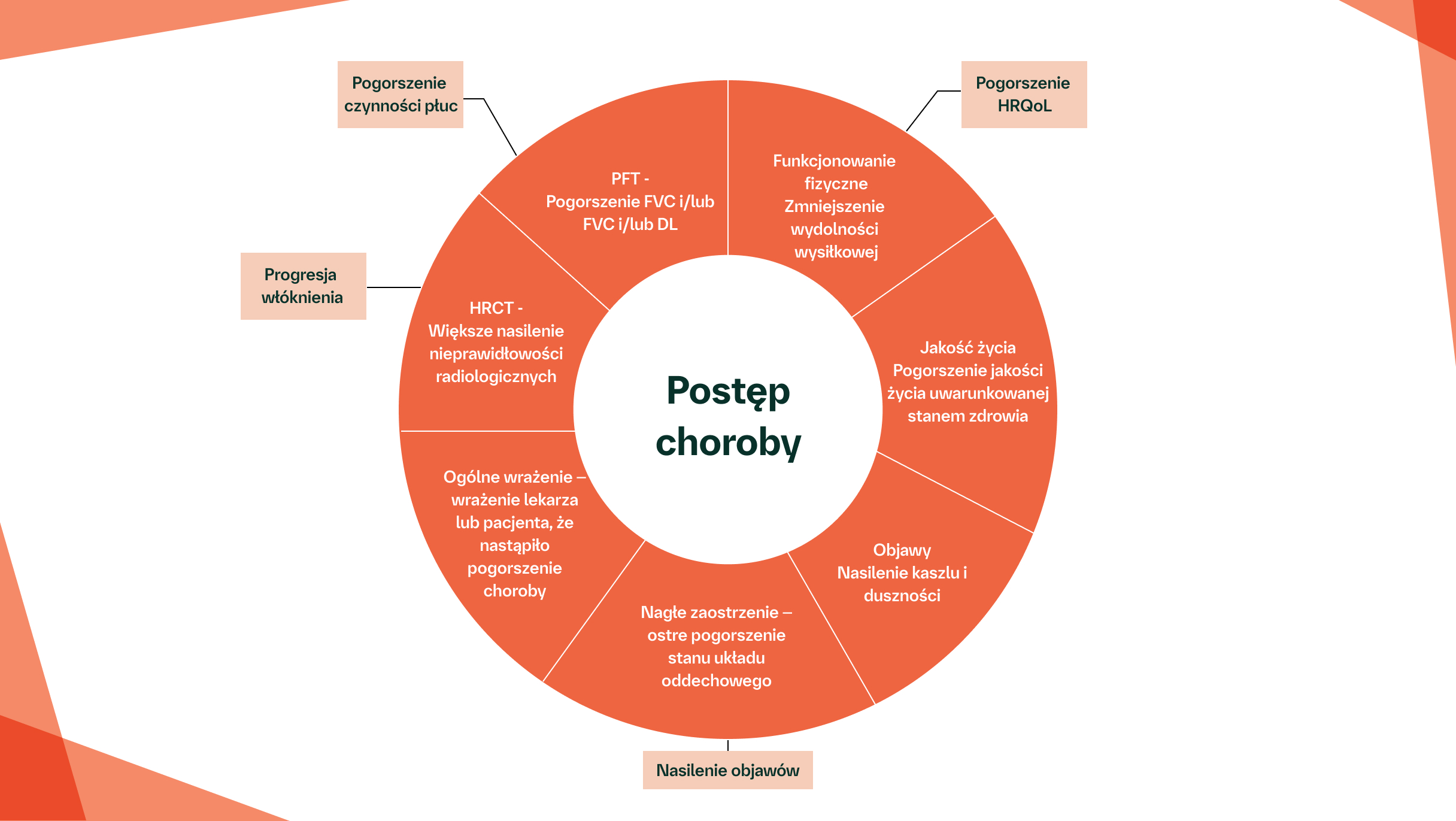
WCZESNE I REGULARNE MONITOROWANIE POD KĄTEM WŁÓKNIENIA PŁUC U PACJENTÓW JEST WAŻNE, ABY JAK NAJSZYBCIEJ WYKRYĆ FENOTYP POSTĘPUJĄCEGO WŁÓKNIENIA11,12
W przypadku podejrzenia postępującej włókniejącej ILD czas ma decydujące znaczenie.3
Opóźnione wykrycie postępującego włóknienia płuc w ILD może być śmiertelnie niebezpieczne: szacuje się, że czas przeżycia pacjentów po wykryciu postępującego włóknienia wynosi 2,5–4 lat2–3†
Wczesna identyfikacja pacjentów z postępującą włókniejącą ILD może wpłynąć na decyzje dotyczące postępowania i poradnictwa dla pacjentów2
CZY MOŻNA SKRÓCIĆ CZAS POMIĘDZY ROZPOZNANIEM ILD A WYKRYCIEM FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA U PACJENTÓW?
W internetowej ankiecie przeprowadzonej wśród lekarzy oceniono, że fenotyp postępującego włóknienia jest wykrywany 9 do 12 miesięcy po jego rozwinięciu się2†
Szacowany czas, jaki upływa od wystąpienia pierwszych objawów ILD do wykrycia fenotypu postępującego włóknienia u pacjentów z różnymi typami ILD2†
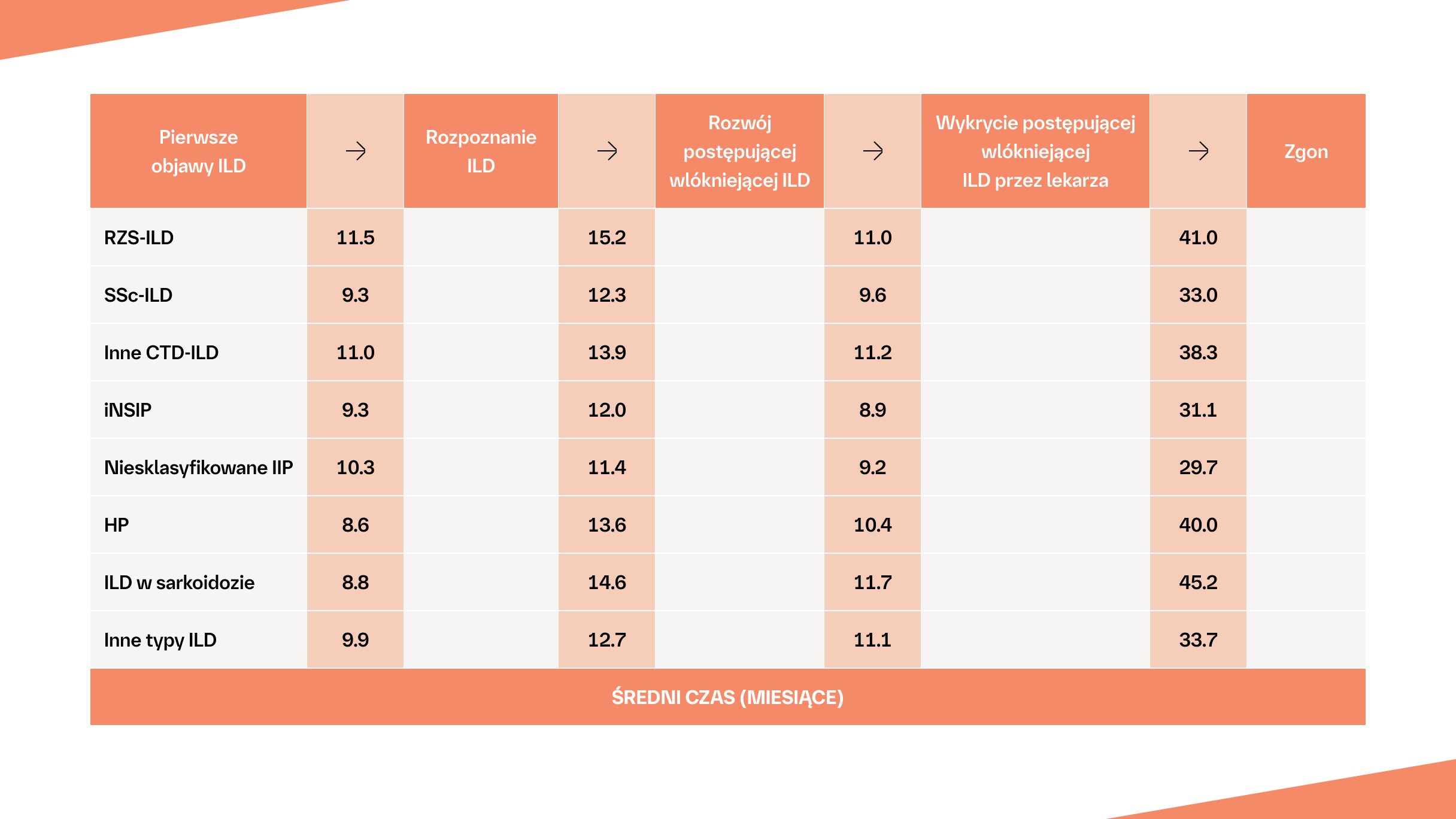
Droga pacjenta z postępującą włókniejącą ILD typu innego bez IPF według internetowej ankiety przeprowadzonej wśród lekarzy.2†
†Dane szacunkowe dotyczące liczby pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii.2
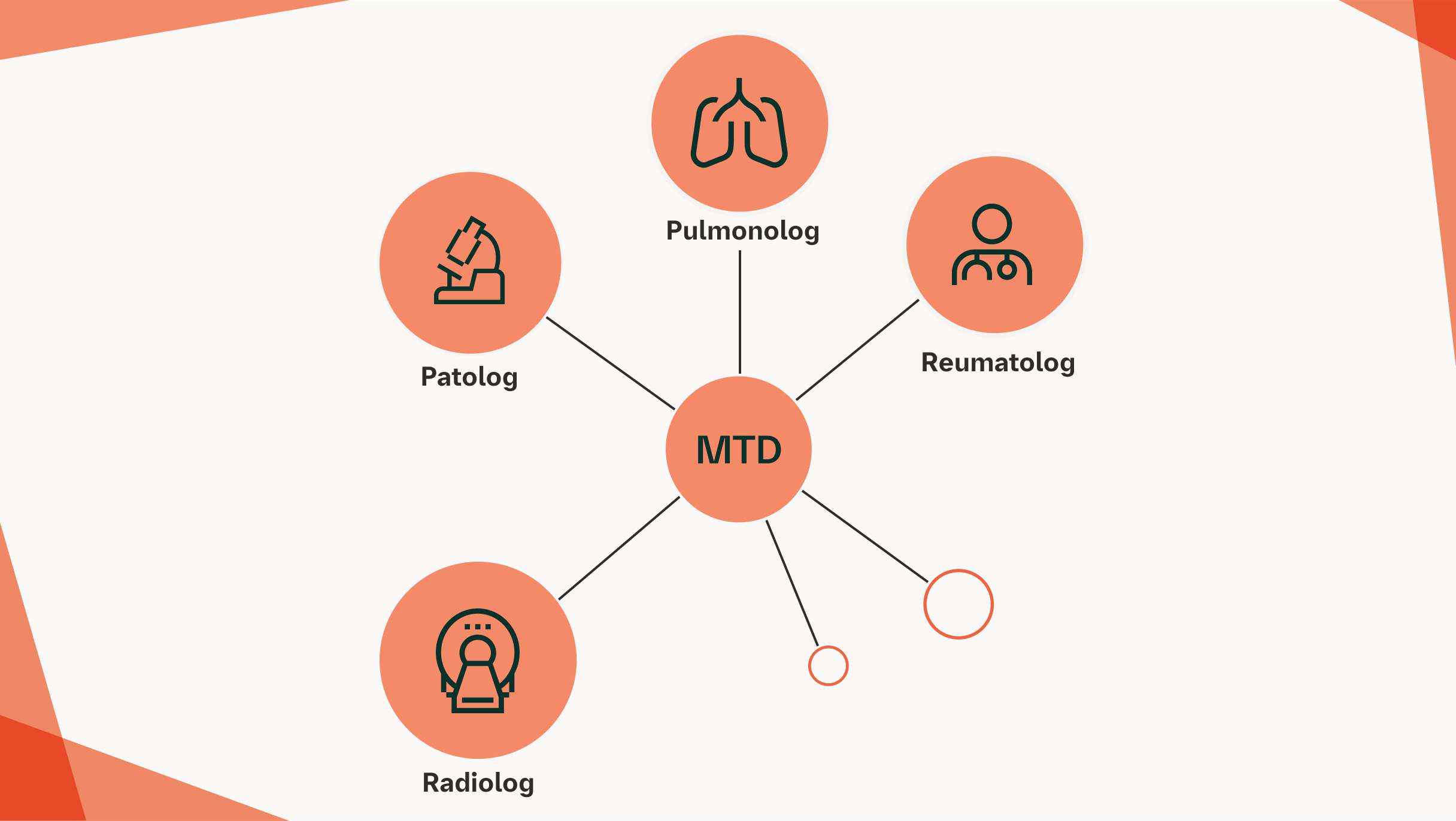
Ocena wielodyscyplinarna stanowi złoty standard w ocenie nasilenia ILD13
Diagnostyka i monitorowanie ILD, która może wykazywać fenotyp postępującego włóknienia3
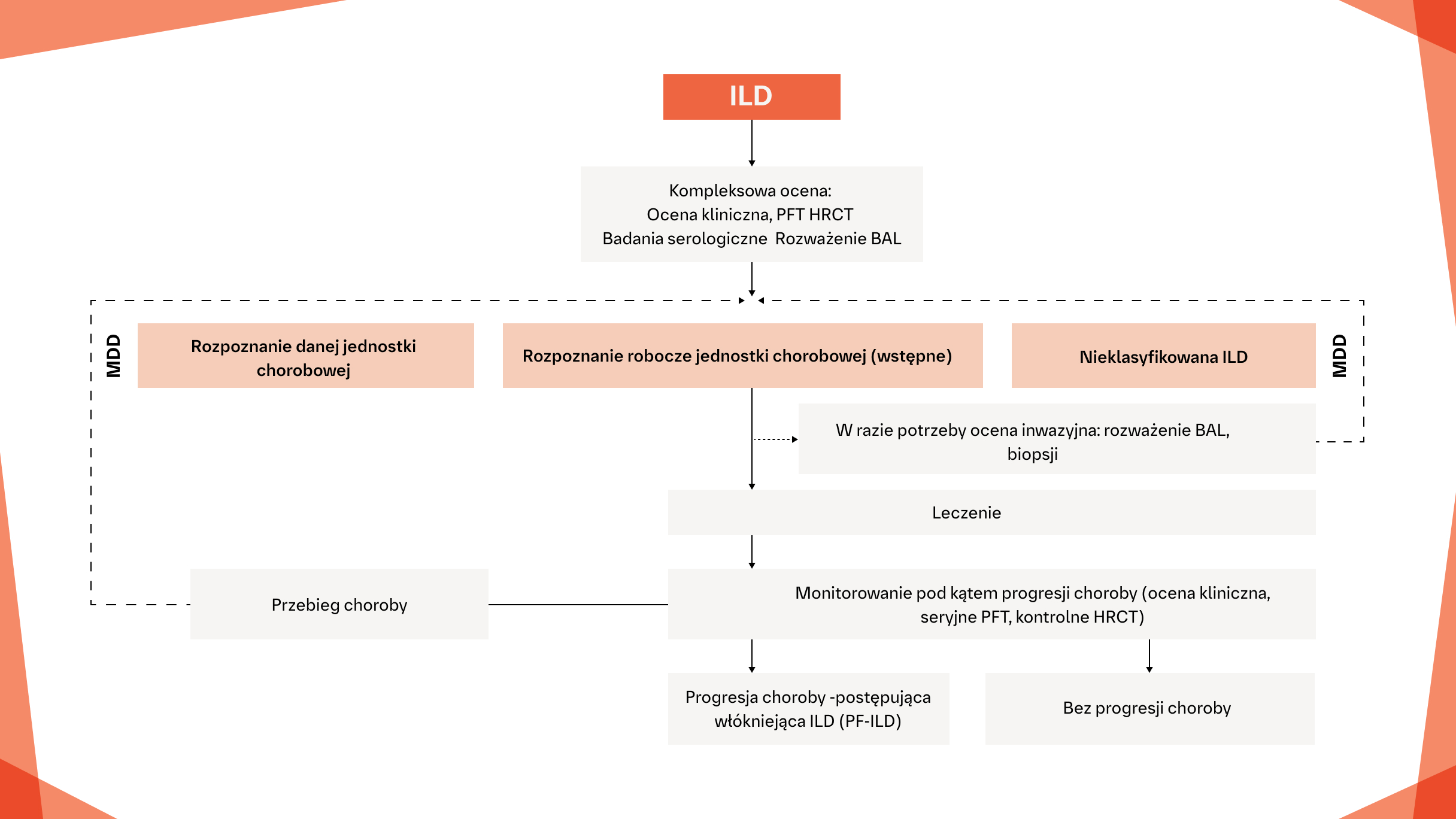
Na podstawie: Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
MONITOROWANIE POD KĄTEM FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA ZA POMOCĄ BADAŃ PFT, HRCT I OCENY OBJAWÓW



Monitorowanie progresji ILD za pomocą PFT:
Pogorszenie wyników PFT powinno skłaniać do pilnego wykonania dalszych badań, ponieważ włóknienie płuc jest nieprzewidywalne1,14
Obniżenie DL∞ często uważa się za oznakę postępującej ILD, zwłaszcza gdy towarzyszy mu spadek FVC lub narastające z czasem radiologiczne oznaki włóknienia w badaniach HRCT6
Potwierdzenie progresji ILD za pomocą badania HRCT:
W przypadku pacjentów, u których istnieje ryzyko rozwoju fenotypu postępującego włóknienia, ocenę HRCT należy wykonać po stwierdzeniu pogorszenia się wyników PFT bądź nasilenia objawów ze strony układu oddechowego3,15–17
Inne istotne kwestie w kontekście monitorowania progresji ILD


KWESTIE DOTYCZĄCE MONITOROWANIA OKREŚLONYCH TYPÓW ILD
ŚRÓDMIĄŻSZOWA CHOROBA PŁUC W PRZEBIEGU TWARDZINY UKŁADOWEJ (SSc‑ILD)
Ze względu na zmienny i nieprzewidywalny charakter włóknienia płuc w SSc, należy prowadzić ciągłe, czujne monitorowanie, z powtarzaniem badań HRCT w przypadku pogorszenia się wyników PFT lub nasilenia objawów ze strony układu oddechowego:11,18–21
- Wszyscy pacjenci z SSc‑ILD powinni być kontrolowani co 3–6 miesięcy z wykonaniem badań PFT oraz ewentualnym powtarzaniem badań HRCT zależnie od decyzji klinicznej19,20
Algorytm monitorowania SSc‑ILD19
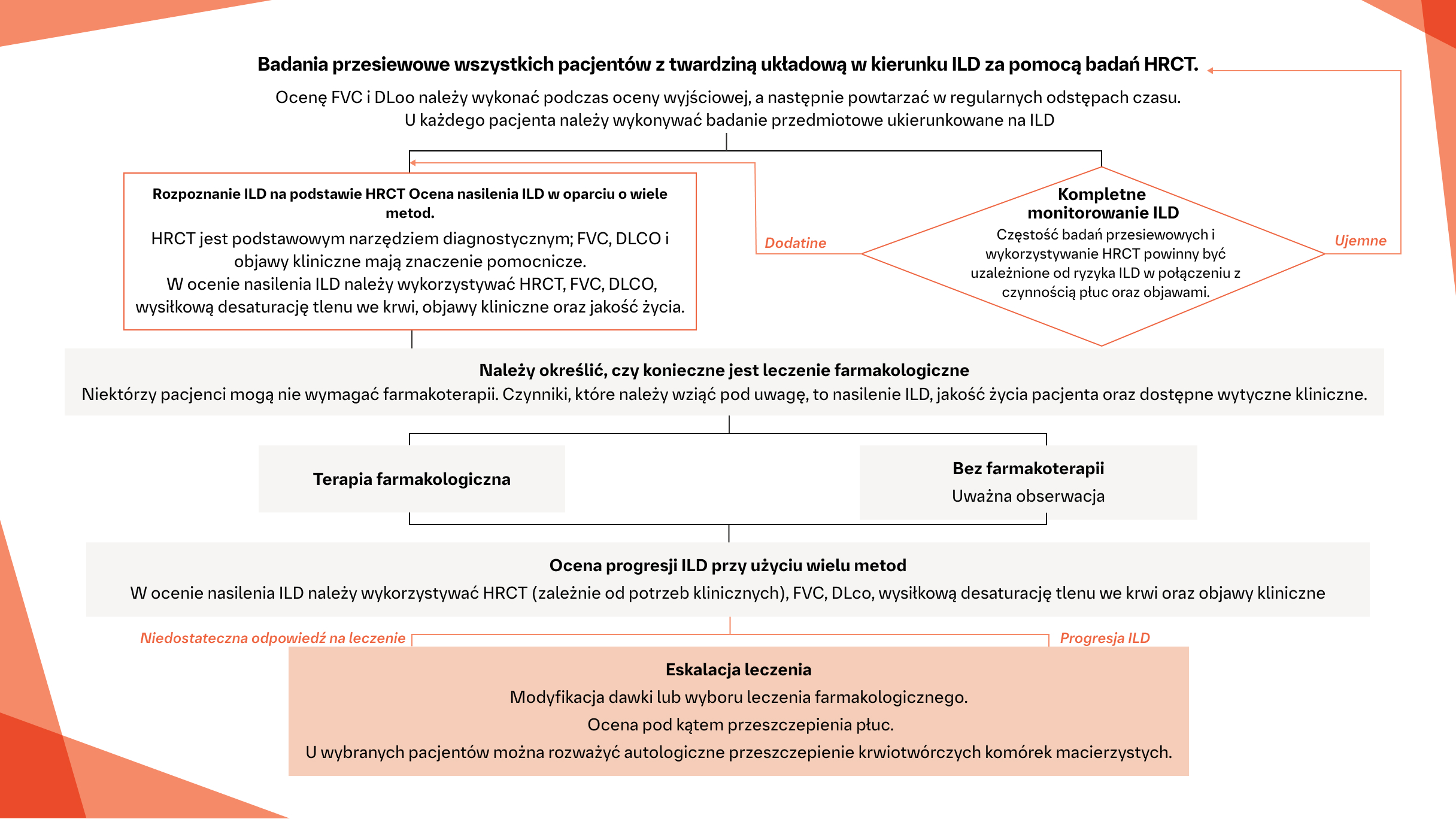
Algorytm ten zawiera krótkie podsumowanie konsensusu opartego na dowodach (z uwzględnieniem uzupełniającego procesu Delphi) w odniesieniu do identyfikacji i postępowania w SSc‑ILD – do wykorzystania w praktyce klinicznej. Należy zachować ostrożność przy ekstrapolowaniu danych uzyskanych w populacji pacjentów z SSc‑ILD na inne choroby tkanki łącznej.
Na podstawie: Hoffmann-Vold A i wsp. Lancet Rheumatol. 2020;https://doi.org/10.1016/S2665-9913(19)30144-4.
Więcej informacji na temat monitorowania pod kątem progresji ILD w SSc‑ILD
ŚRÓDMIĄŻSZOWA CHOROBA PŁUC W PRZEBIEGU REUMATOIDALNEGO ZAPALENIA STAWÓW (RZS‑ILD)
U pacjentów z bezobjawową RZS‑ILD konieczna jest obserwacja w celu identyfikacji progresji choroby:22
Zaleca się monitorowanie pod kątem progresji RZS‑ILD poprzez wykonywanie badań PFT co 3–6 miesięcy23
Co jeszcze można zrobić, aby monitorować progresję ILD w RZS‑ILD?
Jakie opcje postępowania należy rozważyć u pacjentów z włókniejącą ILD?
Interwencje w ILD
Zapewnienie opieki paliatywnej/wspomagającej

Zespoły wielodyscyplinarne
-
Raghu G, Collard HR, Egan JJ i wsp.; w imieniu Komitetu ATS/ERS/JRS/ALAT ds. Idiopatycznego Włóknienia Płuc. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
-
Wijsenbeek M, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019;35(11):2015–2024.
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
George PM, Spagnolo P, Kreuter M i wsp. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Cottin V, Richeldi L. Neglected evidence in idiopathic pulmonary fibrosis and the importance of early diagnosis and treatment. Eur Respir Rev. 2014;23(131):106–110.
-
Lamas D, Kawut SM, Bagiella E i wsp. Delayed Access and Survival in Idiopathic Pulmonary Fibrosis. Am J Respir Crit Care Med. 2011;184(7):842–847.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Chowaniec M, Skoczynska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
-
Cottin V, Brown KK. Interstitial lung disease associated with systemic sclerosis (SSc‑ILD). Respir Res. 2019a;20(1):13.
-
Chaudhuri N, Spencer L, Greaves M i wsp. A Review of the Multidisciplinary Diagnosis of Interstitial Lung Diseases: A Retrospective Analysis in a Single UK Specialist Centre. J Clin Med. 2016;5(66):1–9.
-
Martinez FJ, Flaherty K. Pulmonary function testing in idiopathic interstitial pneumonias. Proc Am Thorac Soc. 2006;3(4):315–321.
-
Roofeh D, Jaafar S, Vummidi D, Khanna D. Management of systemic sclerosis-associated interstitial lung disease. Curr Opin Rheumatol. 2019;31(3):241–249.
-
Walsh SLF, Devaraj A, Enghelmayer JI i wsp. Role of imaging in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180073.
-
Elicker BM, Kallianos KG, Henry TS. The role of high-resolution computed tomography in the follow-up of diffuse lung disease: Number 2 in the Series “Radiology” Edited by Nicola Sverzellati and Sujal Desai. Eur Respir Rev.2017;26(144):pii:170008.
-
Hoffmann-Vold AM, Allanore Y, Alves M i wsp. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020;217455.
-
Hoffmann-Vold AM, Maher TM, Philpot EE i wsp. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2:e71–e83.
-
Distler O, Assassi S, Cottin V i wsp. Predictors of progression in systemic sclerosis patients with interstitial lung disease. Eur Respir J. 2020;55,1902026.
-
Cappelli S, Bellando Randone S, Camiciottoli G i wsp. Interstitial lung disease in systemic sclerosis: where do we stand? Eur Respir Rev. 2015;24:411–419.
-
Cassone G, Manfredi A, Vacchi C i wsp. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082.
-
Iqbal K and Kelly C. Treatment of rheumatoid arthritis-associated interstitial lung disease: a perspective review. Ther Adv Musculoskelet Dis. 2015;7(6):247–267.
-
Ryerson CJ, Cayou C, Topp F i wsp. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203–210.
-
Kreuter M, Bendstrup E, Russell A i wsp. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968–980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [publikacja elektroniczna przed drukiem].
-
Sgalla G, Cerri S, Ferrari R i wsp. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
-
Maher TM, Molina-Molina M, Russell AM i wsp. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
-
Robalo-Cordeiro C, Campos P, Carvalho L i wsp. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
Materiały dla pacjentów po angielsku




