Nagłe zaostrzenie ILD charakteryzuje się szybkim pogarszaniem się stanu układu oddechowego (wyraźne nasilenie duszności i hipoksemii)1
Jako nieprzewidywalne, poważne zdarzenie zagrażające życiu, nagłe zaostrzenie ILD może wystąpić w każdym momencie w przebiegu choroby.1 Nagłe zaostrzenie ILD wiąże się z niekorzystnym rokowaniem i wysokim wskaźnikiem śmiertelności1
NAGŁE ZAOSTRZENIE IPF: POWIĄZANE RYZYKO I WPŁYW NA PRZEŻYWALNOŚĆ
Nawet 1 na 5 pacjentów z IPF rocznie jest narażony na związane z ryzykiem zgonu nagłe zaostrzenie IPF.6
Niska przeżywalność po nagłym zaostrzeniu IPF7
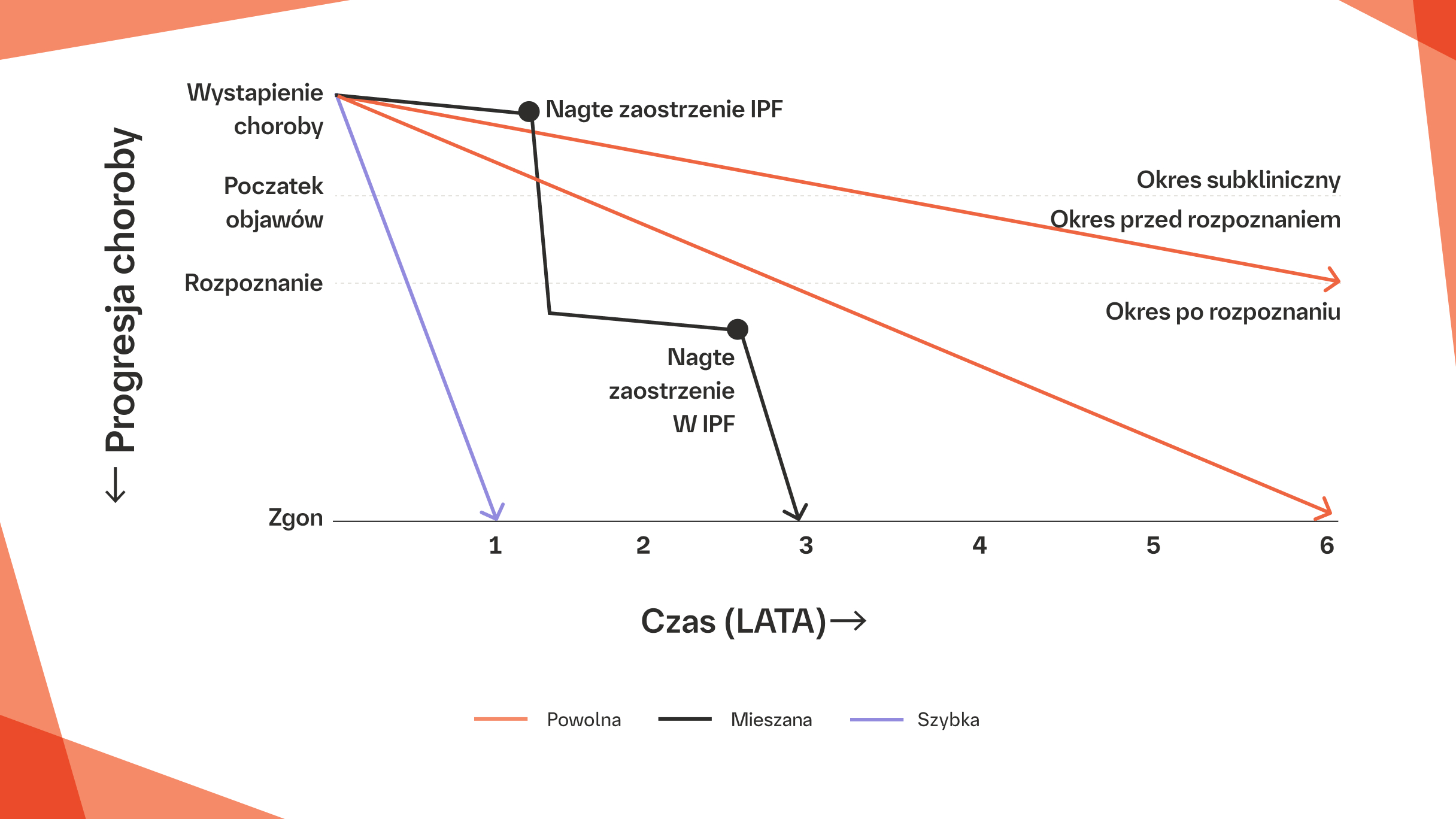
Wśród 163 pacjentów, u których nastąpiło szybkie pogorszenie (RD), najczęstszą przyczyną RD było nagłe zaostrzenie IPF (90 pacjentów), a następnie zakażenie (51 pacjentów).2
Porównanie krzywych przeżycia (od szybkiego pogorszenia do zgonu lub ostatniego kontaktu) pomiędzy pacjentami z IPF z nagłym zaostrzeniem IPF i z zakażeniem.2
U pacjentów z IPF nagłe zaostrzenie IPF oraz pogorszenie FVC są związane z większą śmiertelnością8


Niska przeżywalność po nagłym zaostrzeniu IPF2
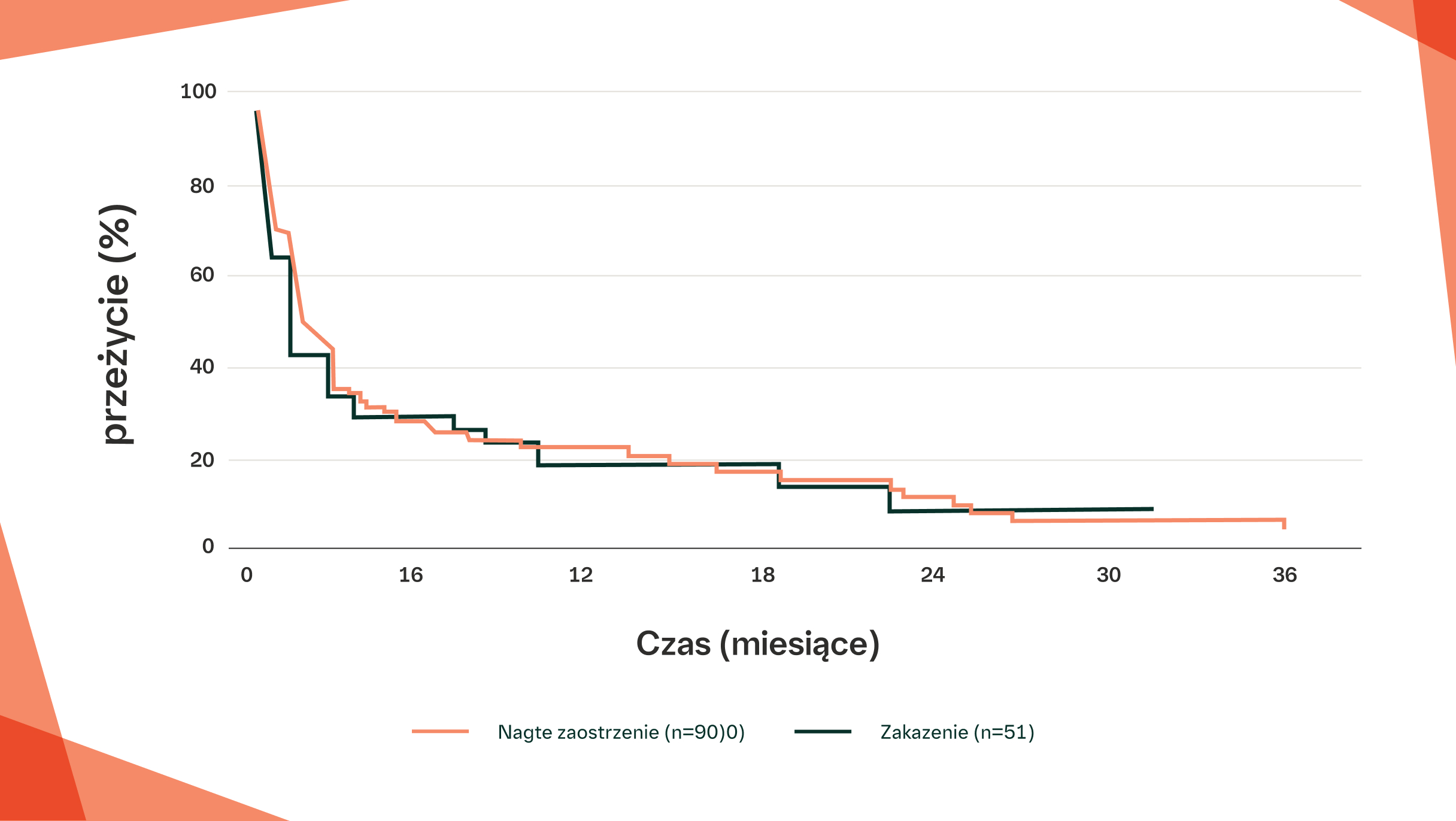
Wśród 163 pacjentów, u których nastąpiło szybkie pogorszenie (RD), najczęstszą przyczyną RD było nagłe zaostrzenie (AE) (90 pacjentów), a następnie zakażenie (51 pacjentów).2
Porównanie krzywych przeżycia (od szybkiego pogorszenia do zgonu lub ostatniego kontaktu) pomiędzy pacjentami z IPF z nagłym zaostrzeniem i z zakażeniem.2
Porównanie ryzyka zgonu z powodu nagłego zaostrzenia IPF oraz kategorialnych spadków % wartości należnej FVC8
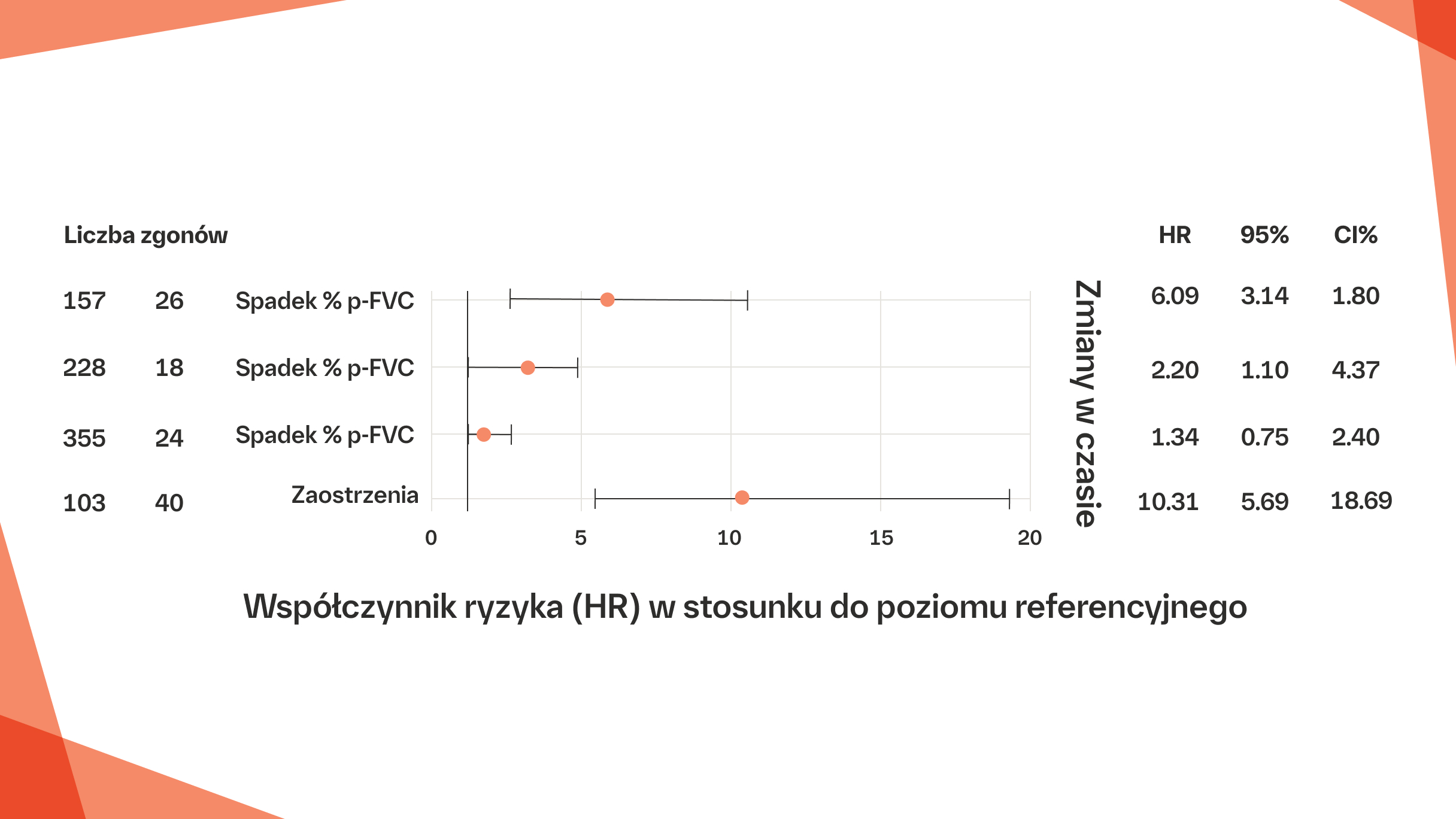
Skorygowany HR i 95% CI dla zgonu w zależności od spadku % wartości należnej FVC (%p-FVC) i nagłych zaostrzeń.
Dokonano porównania z poziomem referencyjnym dla wyjściowej czynności płuc (% wartości należnej FVC) i zmiennych dotyczących zmian w czasie (spadek % wartości należnej FVC, <5, bez zaostrzenia). *Zmienne dotyczące zmian w czasie traktowano jako współzmienne ulegające zmianom w czasie w modelu hazardów proporcjonalnych Coxa.
Porównanie krzywych przeżycia (od początkowego rozpoznania do zgonu lub ostatniego kontaktu) pomiędzy pacjentami z IPF bez szybkiego pogorszenia, z ogniskowym szybkim pogorszeniem, z obustronnym zakażeniem i z nagłym zaostrzeniem.2
ŚMIERTELNOŚĆ PO ZAOSTRZENIU W TYPACH ILD INNYCH NIŻ IPF
Śmiertelność po zaostrzeniu ILD wynosi od 33% do 83%.1 Śmiertelność szpitalna u pacjentów z HP wynosi od 75% do 100%1
W badaniu południowokoreańskim – retrospektywnym przeglądzie obejmującym 84 pacjentów z RZS‑ILD, u 17% pacjentów z RZS‑ILD wystąpiło nagłe zaostrzenie ILD w okresie 33 miesięcy3

Porównanie krzywych przeżycia wśród pacjentów z RZS‑ILD z obrazem UIP w badaniu HRCT o różnym przebiegu obserwacji3
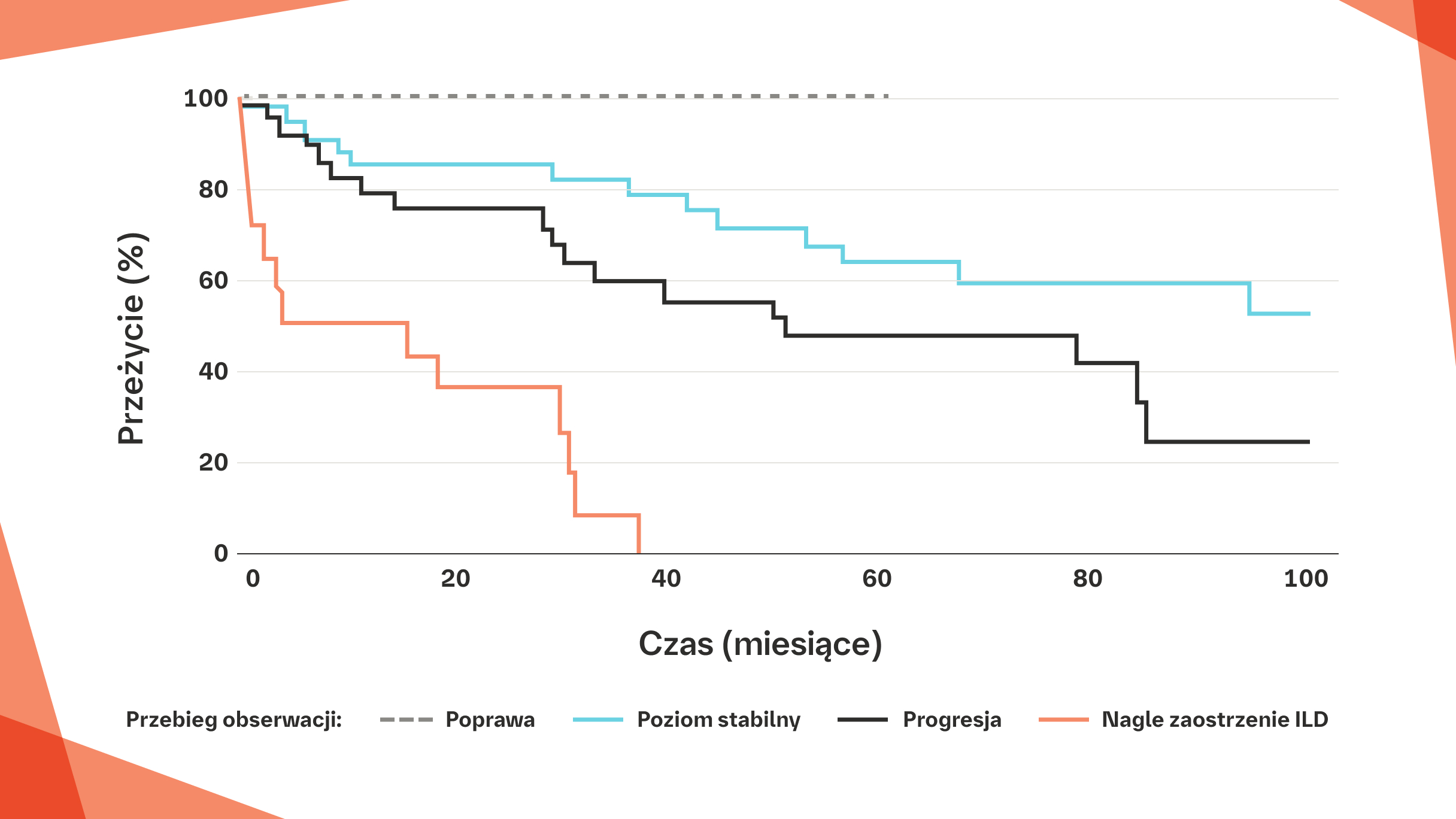
Porównanie krzywych przeżycia wśród pacjentów z RZS‑ILD z obrazem UIP w badaniu HRCT o różnym przebiegu obserwacji3
Poprawa (n=5), stabilizacja (n=37), progresja (n=28), nagłe zaostrzenie ILD (n=14).
Poprawę i progresję zdefiniowano jako zmianę FVC o >10% i/lub zmianę DL∞>15%.
Na podstawie: Song JW i wsp. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30:103–112.
Jak można ocenić ryzyko związane z nagłym zaostrzeniem ILD i jakie działania można podjąć, aby zmniejszyć to ryzyko?
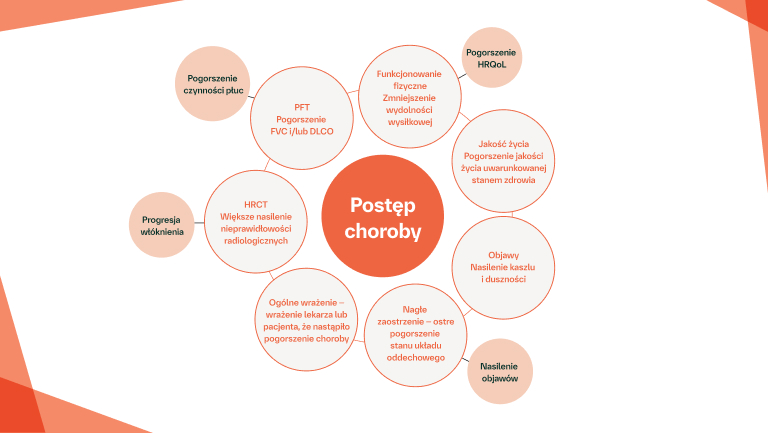
W ILD typu innego niż IPF również może rozwinąć się fenotyp progresywny

Wczesne i regularne monitorowanie
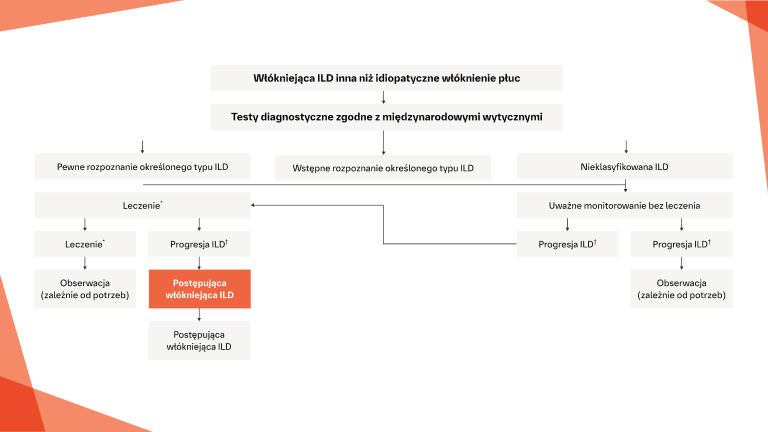
Interwencje w ILD
-
Kolb M, Bondue B, Pesci A i wsp. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
-
Song JW, Hong S-B, Lim C-M i wsp. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome. Eur Respir J. 2011;37(2):356–363.
-
Song JW, Lee HK, Lee CK i wsp. Clinical course and outcome of rheumatoid arthritis-related usual interstitial pneumonia. Sarcoidosis Vasc Diffuse Lung Dis. 2013;30(2):103–112.
-
Tomiyama F, Watanabe R, Ishii T i wsp. High Prevalence of Acute Exacerbation of Interstitial Lung Disease in Japanese Patients with Systemic Sclerosis. Tohoku J. Exp. Med. 2016;239, 297–305.
-
Okamoto M, Fujimoto K, Sadohara J i wsp. A retrospective cohort study of outcome in systemic sclerosis-associated interstitial lung disease. Respiratory Investigation. 2016;54, 445–453.
-
Ryerson C, Cottin V, Brown K, Collard H. Acute exacerbation of idiopathic pulmonary fibrosis: shifting the paradigm. Eur Respir J. 2015;46(2):512–520.
-
Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;183(4):431–440.
-
Paterniti MO, Bi Y, Reki D i wsp. Acute exacerbation and decline in forced vital capacity are associated with increased mortality in idiopathic pulmonary fibrosis. Ann Am Thorac Soc. 2017;14(9):1395–1402.
-
Collard HR, Ryerson CJ, Corte TJ i wsp. Acute exacerbation of idiopathic pulmonary fibrosis: an international working group report. Am J Respir Crit Care Med. 2016;194(3):265–275.
-
Hyldgaard C, Ellingsen T, Hilberg O i wsp. Rheumatoid arthritis-associated interstitial lung disease: clinical characteristics and predictors of mortality. Respiration. 2019;98(5):455–460.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of ... in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Maher TM, Molina-Molina M, Russell AM i wsp. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Robalo-Cordeiro C, Campos P, Carvalho L i wsp. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
Materiały dla pacjentów po angielsku





