Fenotyp postępującego włóknienia w ILD
U 18% do 32% pacjentów z ILD typu innego niż IPF może rozwinąć się fenotyp postępującego włóknienia1

IDENTYFIKACJA FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA W ILD
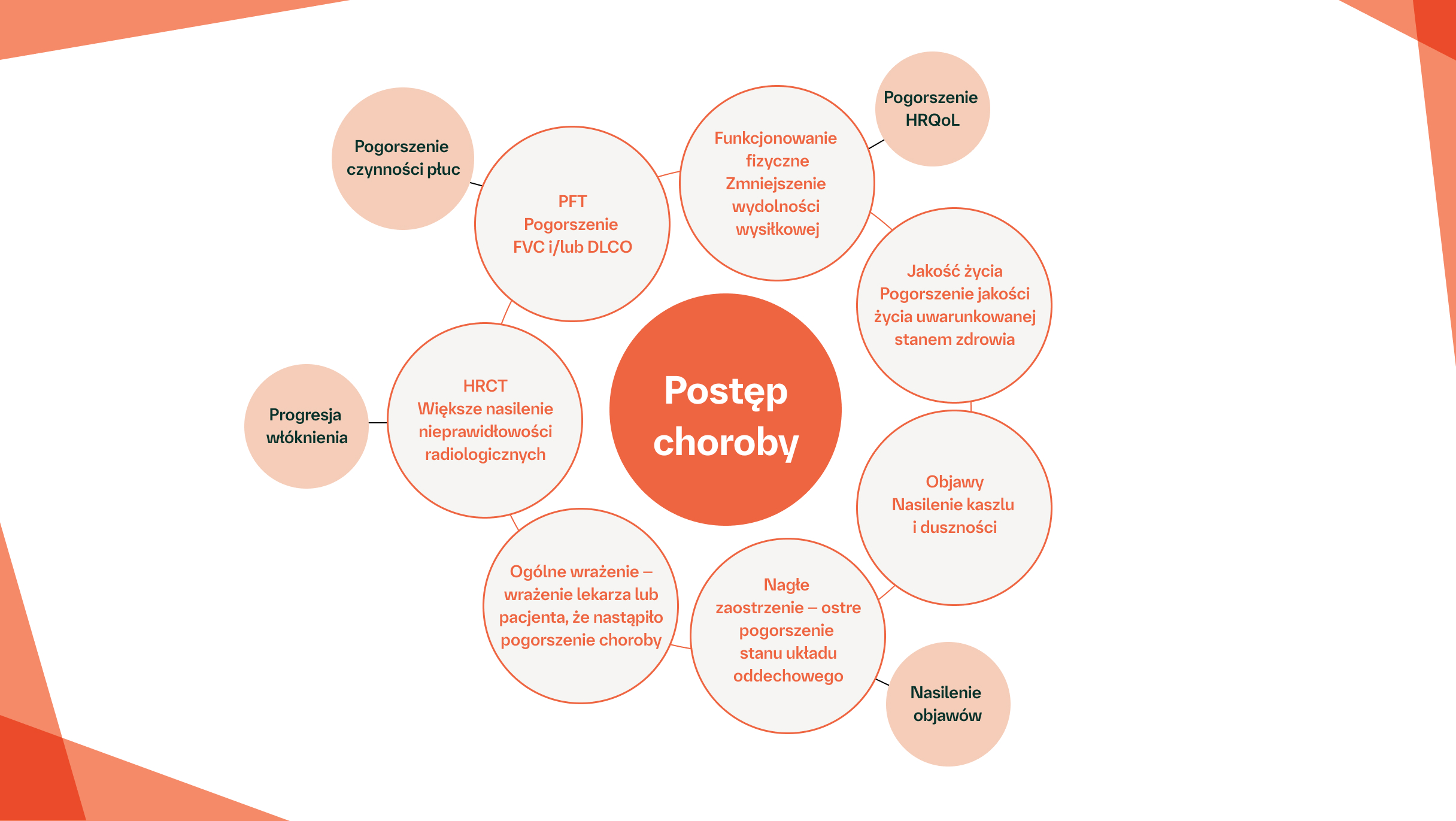
W ILD fenotyp postępującego włóknienia definiuje się jako obecność:2–5



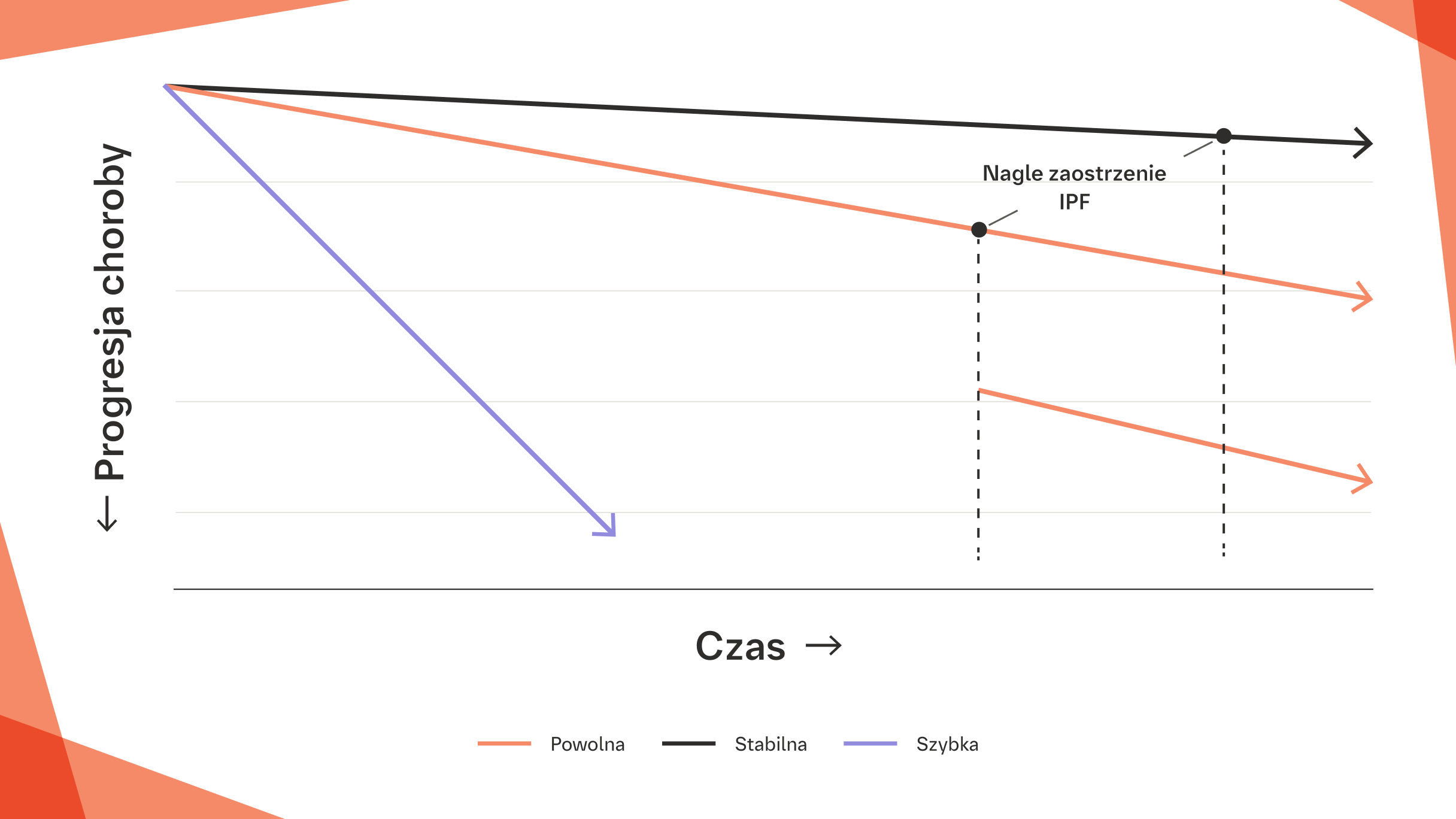
PROGRESJA IPF MOŻE NASTĘPOWAĆ SZYBKO OD CHWILI ROZPOZNANIA9
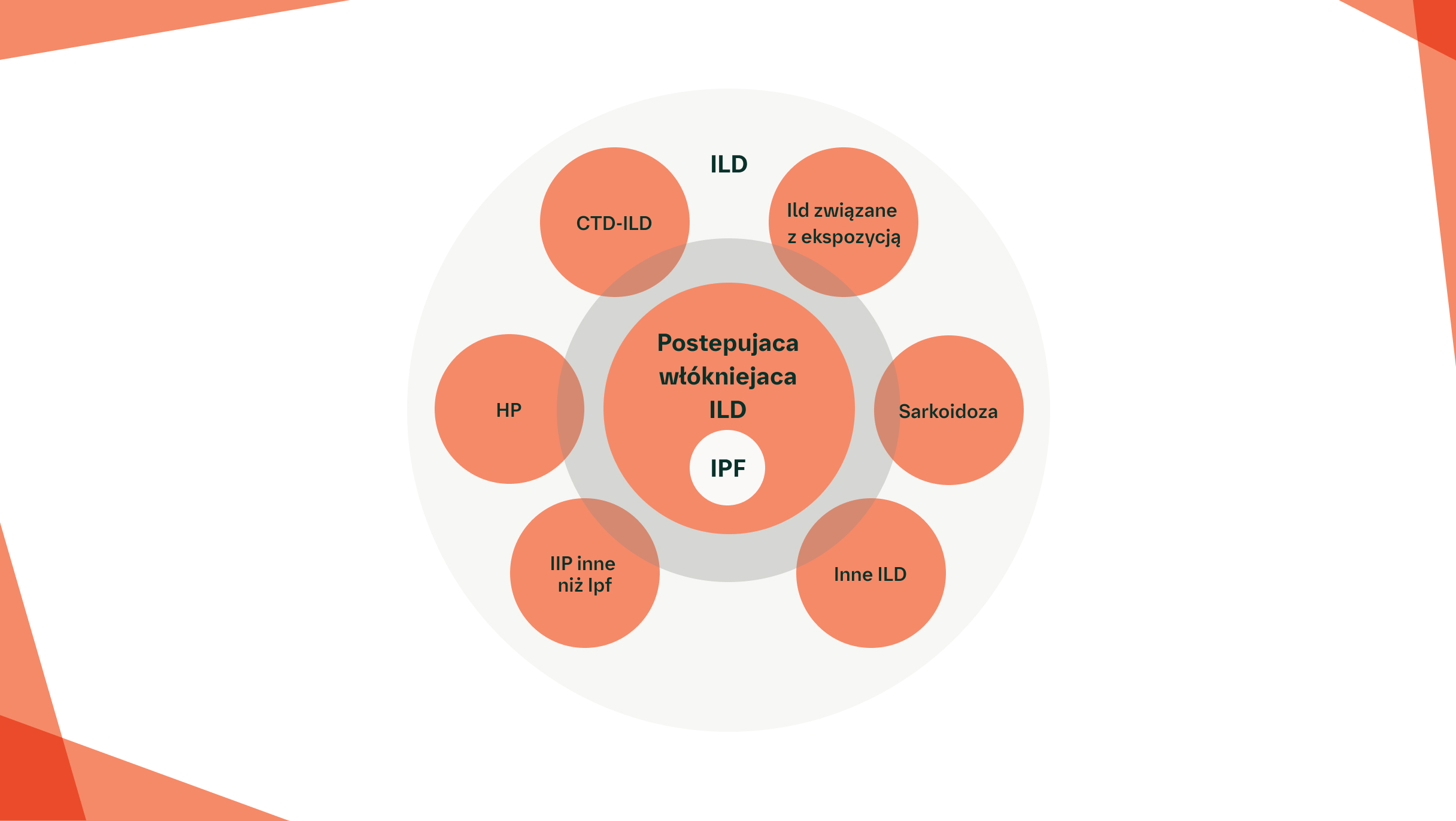
W KTÓRYCH TYPACH ILD MOŻE ROZWIJAĆ SIĘ FENOTYP POSTĘPUJĄCEGO WŁÓKNIENIA?
Typy ILD, które mogą być związane z fenotypem postępującego włóknienia2,5
CZĘSTOŚĆ WYSTĘPOWANIA FENOTYPU POSTĘPUJĄCEGO WŁÓKNIENIA U PACJENTÓW Z ILD
Szacowany odsetek pacjentów z rozpoznaniem ILD*, u których może rozwinąć się fenotyp postępującego włóknienia12
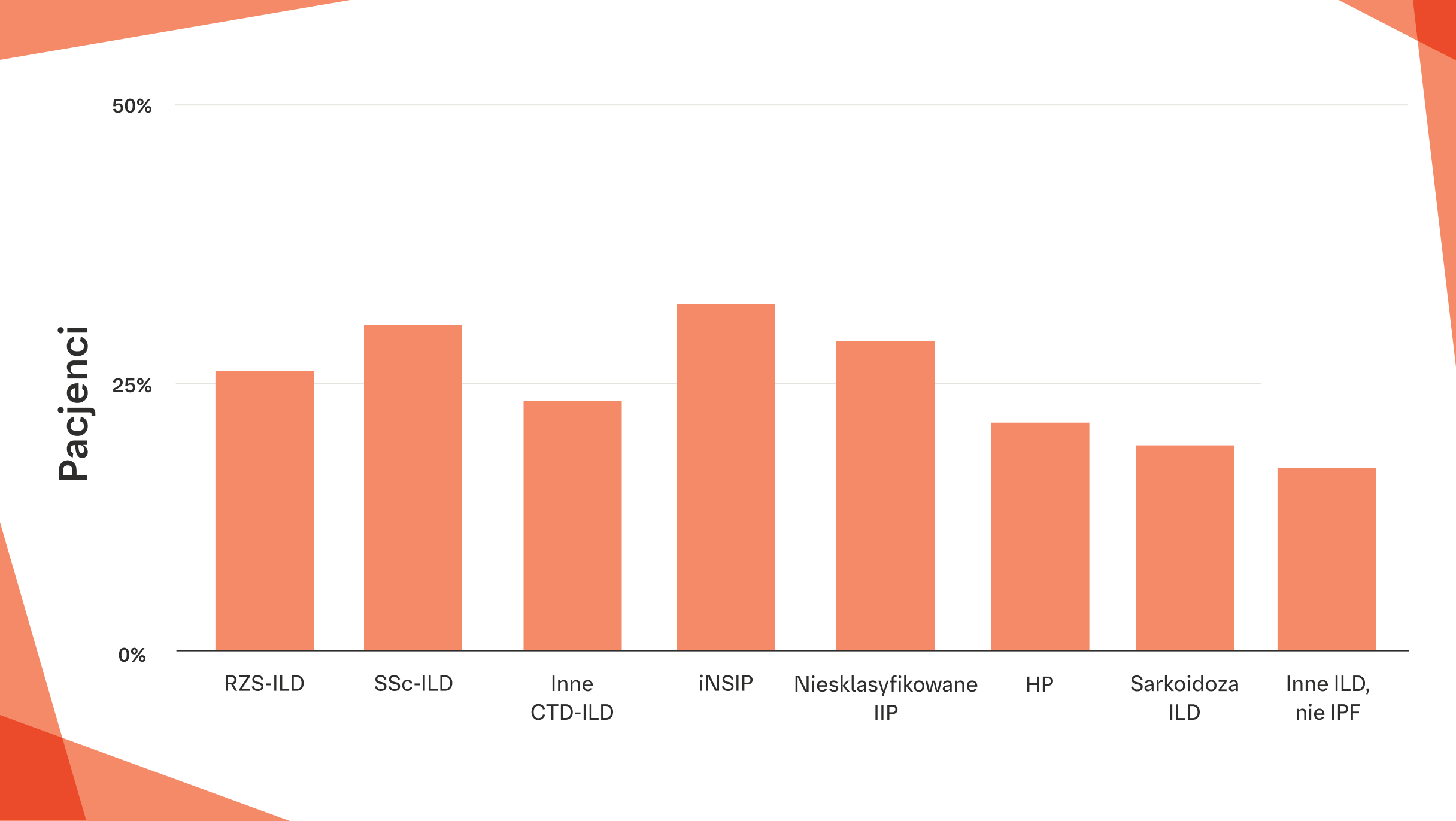
W oparciu o ankietę internetową wśród lekarzy.†‡§¶
Łączna częstość występowania ILD (innych niż IPF) o fenotypie postępującego włóknienia prawdopodobnie jest taka sama lub większa niż częstość występowania IPF13,14
OBCIĄŻENIE ZWIĄZANE Z POSTĘPUJĄCĄ WŁÓKNIEJĄCĄ ILD MOŻE ZNACZNIE ZREDUKOWAĆ JAKOŚĆ ŻYCIA PACJENTA UWARUNKOWANĄ STANEM ZDROWIA3
U pacjentów z postępującą włókniejącą ILD kaszel, duszność i uczucie zmęczenia ograniczają wydolność funkcjonowania fizycznego, a także zdolność do wykonywania podstawowych czynności i uczestniczenia w życiu codziennym3,15–17



Oprócz wpływu na funkcjonowanie, u pacjentów z postępującą włókniejącą ILD może występować stres emocjonalny, w tym depresja, poczucie bezsilności i utraty niezależności.3,15,17–19




Pacjenci z postępującą włókniejącą ILD, taką jak IPF, HP i CTD‑ILD, niemal zawsze zgłaszają objawy lęku i/lub depresji.17,19
ODKRYJ WSZYSTKIE SKUTKI POSTĘPUJĄCEJ WŁÓKNIEJĄCEJ ILD
Przegląd cech charakterystycznych i rozpowszechnienia fenotypu postępującego włóknienia w różnych typach ILD
Dr Nazia Chaudhuri przedstawia fizyczny i emocjonalny wpływ fenotypu postępującego włóknienia na pacjentów oraz opisuje, w jaki sposób może się on rozwinąć w ILD niezależnie od czynnika wywołującego
Patients with interstitial lung diseases face an unpredictable journey. There are over 200 types of ILDs, of which Idiopathic pulmonary fibrosis, or IPF, is the most common fibrosing type. Around 1 in 5 patients with differing ILD diagnoses may develop a ‘progressive fibrosing phenotype’. Progressive fibrosing ILDs are believed to progress via common pathobiological fibrotic pathways, independent of the original trigger. These progressive fibrosing ILDs are characterised by self-sustaining, diffuse and irreversible fibrosis, worsening respiratory symptoms and declining lung function. The progressive and permanent fibrotic lung damage can place an overwhelming burden on patient’s quality of life and is associated with high mortality. No treatments are currently approved for progressive fibrosing ILDs, other than IPF. Thus, there is a high unmet need for effective treatments that slow the disease progression in these patients. Boehringer Ingelheim has a strong commitment to scientific research. The INBUILD® clinical trial is the first and largest phase III global trial to include patients across the broad spectrum of ILDs that develop the ‘progressive fibrosing phenotype’, into a single trial. So together, we hope to help patients with progressive fibrosing ILDs find new ways forward.
My name’s Nazia Chaudhuri, I’m a chest physician and the clinical lead of the Interstitial Lung Disease unit at the Manchester University NHS Foundation trust. I’m also the Chief Investigator of the progressive fibrosing interstitial lung disease clinical trial. What I thought I’d do today first, before I talk to you about the trial is just remind everybody what fibrosis means to a patients and what impact it has on our patients. One of the difficult things I find as a doctor when I have a patient in front of me with fibrosing lung disease, is to actually explain to them that it is an incurable disease and it often is progressive. Our patients will develop progressive breathlessness and cough, as well as anxiety and depression and at the moment, there’s very little evidence-based treatments for progressive interstitial lung disease bar idiopathic pulmonary fibrosis. There are a number of fibrotic lung diseases that look like and behave like IPF. Like IPF, they have a progressive decline and there’s no established treatments to try and halt that decline. Even though the initial trigger may be different, it’s likely that the pathogenetic mechanisms and the end stage fibrosis is the same. These include patients with connective tissue diseases like rheumatoid arthritis that have similar decline and prognosis as idiopathic pulmonary fibrosis. Other conditions include chronic hypersensitivity pneumonitis, sarcoidosis and asbestosis. These conditions can all have progressive declines in their lung function and can have a major impact on patients with symptoms of breathlessness, cough and can ultimately reduce survival.
Pierwszym krokiem do spowolnienia postępującej włókniejącej ILD jest jej identyfikacja

Wczesne i regularne monitorowanie
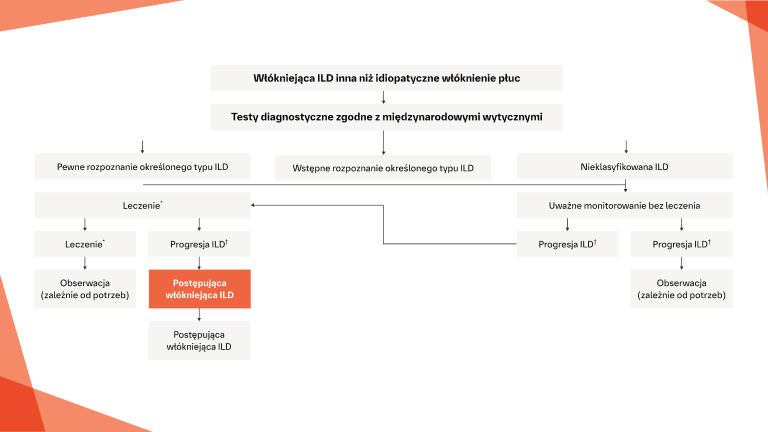
Interwencje w ILD
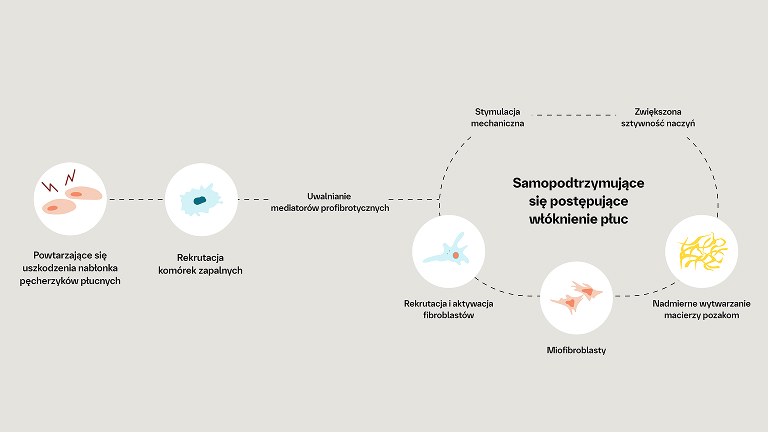
Patofizjologia włókniejącej ILD
Przypisy
-
*
Dane oparte na ankietach internetowych przeprowadzonych w grupie 486 lekarzy. 12
-
†
Pacjenci z rozpoznaniem ILD innej niż IPF.
-
‡
Postępujące włóknienie zdefiniowano jako włóknienie wykryte w badaniu HRCT (tj. zmiany siateczkowe z trakcyjnymi rozstrzeniami oskrzeli, którym może towarzyszyć obraz „plastra miodu”), które jest postępujące pod względem pogarszania się czynności płuc (FVC i/lub DLCO) i/lub objawów oddechowych i/lub zmian w badaniach obrazowych klatki piersiowej.
-
§
Badanie finansowane przez firmę Boehringer Ingelheim.
-
¶
Dane szacunkowe dotyczące odsetka pacjentów z ILD typu innego niż IPF, u których rozwija się postępujące włóknienie, na podstawie ankiety internetowej przeprowadzonej wśród 486 lekarzy (243 pulmonologów, 203 reumatologów i 40 internistów) ze Stanów Zjednoczonych, Japonii, Francji, Niemiec, Włoch, Hiszpanii i Wielkiej Brytanii.
-
Wijsenbeek M, Kreuter M, Fischer A i wsp. Non-IPF progressive fibrosing interstitial lung disease (PF-ILD): the patient journey. Am J Respir Crit Care Med. 2018;197:1–2.
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Flaherty KR, Brown KK, Wells AU i wsp. Design of the PF-ILD trial: A double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Resp Res. 2017;4(1):e000212.
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076. Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Selman M, King TE, Pardo A; American Thoracic Society; European Respiratory Society; American College of Chest Physicians. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med. 2001;134(2):136–151.
-
Bagnato G, Harari S. Cellular interactions in the pathogenesis of interstitial lung diseases. Eur Respir Rev. 2015;24(135):102–114.
-
van Manen MJ, Geelhoed JJ, Tak NC, Wijsenbeek MS. Optimizing quality of life in patients with idiopathic pulmonary fibrosis. Ther Adv Respir Dis. 2017;11(3):157–169.
-
Raghu G, Collard HR, Egan JJ i wsp.; w imieniu Komitetu ATS/ERS/JRS/ALAT ds. Idiopatycznego Włóknienia Płuc. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Vancheri C, Failla M, Crimi N, Raghu G. Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology. Eur Respir J. 2010;35(3):496–504.
-
Wijsenbeek MS, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
-
Holtze C, Flaherty K, Kreuter M i wsp. Healthcare utilisation and costs in the diagnosis and treatment of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180078.
-
Olson AL, Gifford AH, Inase N i wsp. The epidemiology of idiopathic pulmonary fibrosis and interstitial lung diseases at risk of a progressive-fibrosing phenotype. Eur Respir Rev. 2018;27(150):pii:180077.
-
Swigris JJ, Brown KK, Abdulqawi R i wsp. Patients’ perceptions and patient-reported outcomes in progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180075.
-
Olson AL, Brown KK, Swigris JJ. Understanding and optimizing health-related quality of life and physical functional capacity in idiopathic pulmonary fibrosis. Patient Relat Outcome Meas. 2016;7:29–35.
-
Morisset J, Dube B, Garvey C i wsp. The Unmet Educational Needs of Patients with Interstitial Lung Disease: Setting the Stage for Tailored Pulmonary Rehabilitation. Ann Am Thorac Soc. 2016;13:1026–1033.
-
Duck A, Spencer LG, Bailey S i wsp. Perceptions, experiences and needs of patients with idiopathic pulmonary fibrosis. J Adv Nurs. 2014;71(5):1055–1065.
-
Hinz A, Brahler E, Mode R i wsp. Anxiety and depression in sarcoidosis: the influence of age, gender, affected organs, concomitant diseases and dyspnoea. Sarcoidosis Vasc Diffuse Lung Dis. 2012;29(2):139–146.
-
Wuyts WA, Agostini C, Antoniou KM i wsp. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J. 2013;41(5):1207–1218.
Materiały dla pacjentów po angielsku