Interwencje w ILD
Wczesne leczenie ma podstawowe znaczenie w IPF, SSc‑ILD i postępującej włókniejącej ILD typu innego niż IPF, ponieważ może poprawić stan pacjentów1–5

Fenotyp postępującego włóknienia charakteryzuje się zwiększoną rozległością włóknienia, bardziej nasilonymi objawami oddechowymi oraz pogorszeniem czynności płuc.6–9


Należy podkreślać cele leczenia u pacjentów z IPF, takie jak zachowanie czynności płuc i wydłużenie czasu przeżycia, aby pomóc im w podjęciu świadomej decyzji o rozpoczęciu leczenia.21*
Informowanie pacjentów z IPF o tym, w jaki sposób dostosowanie dawki może pomóc w opanowaniu możliwych działań niepożądanych leczenia antyfibrotycznego, może również przekonać ich co do rozpoczęcia terapii, a tym samym wydłużyć okres korzyści wynikających z zastosowania leczenia.18
Jakie są istotne korzyści dotyczące przeżycia w rzeczywistej praktyce u pacjentów z IPF otrzymujących leki antyfibrotyczne?*
Dane z rzeczywistych obserwacji wskazują na znaczną poprawę przeżywalności pacjentów z IPF przyjmujących leczenie antyfibrotyczne w porównaniu z tymi, którzy go nie stosują.22,23
Europejski rejestr IPF: znaczna poprawa przeżywalności pacjentów z IPF leczonych lekami antyfibrotycznymi w porównaniu z pacjentami nieleczonymi22†
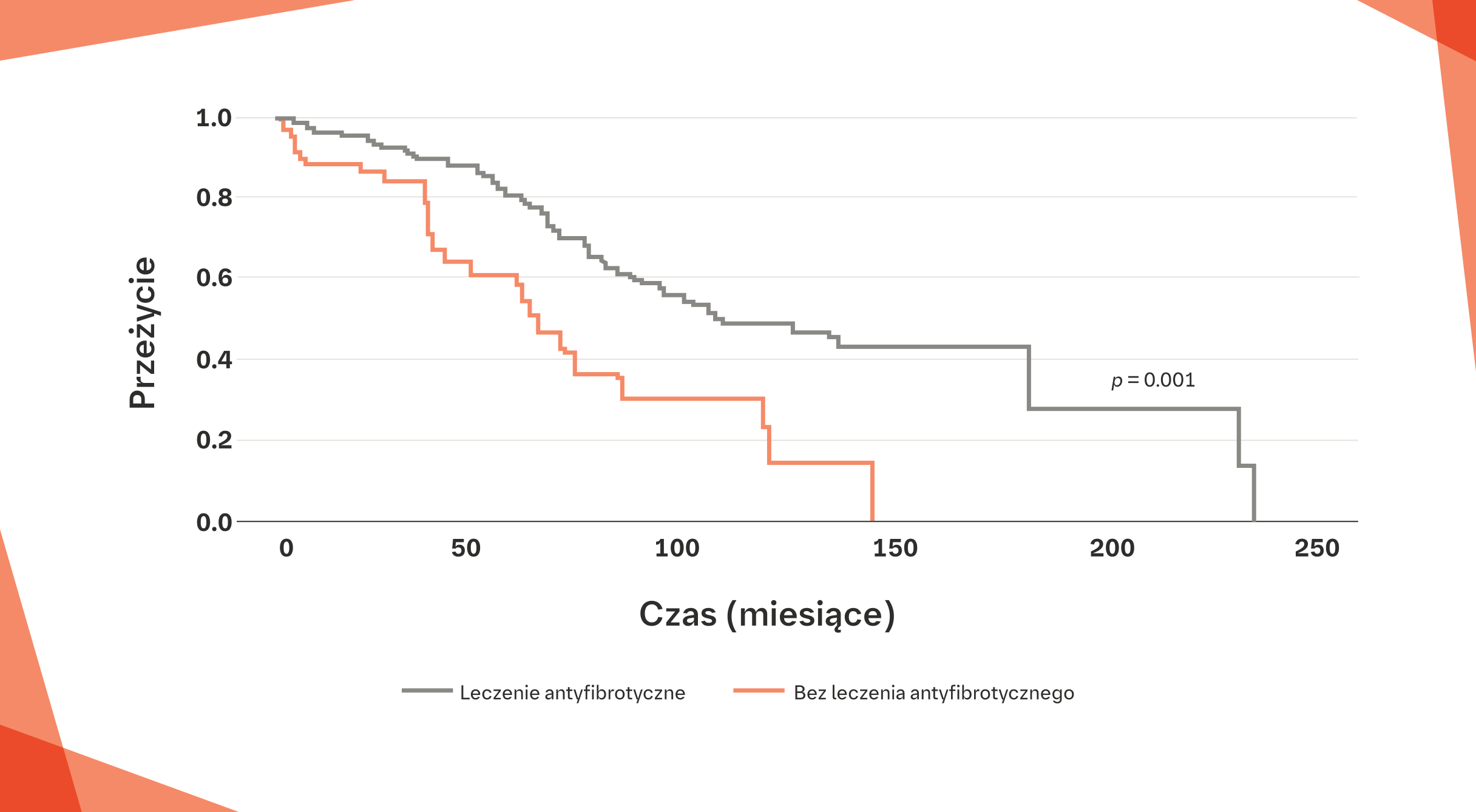
* Krzywe Kaplana‑Meiera dla skumulowanego przeżycia, oparte na definitywnych danych (status przeżycia definitywnie znany na koniec 2016 r.), jak też na danych dotyczących ostatniej wizyty.22
† Stwierdzono statystycznie istotną różnicę w przeżywalności między pacjentami otrzymującymi leczenie antyfibrotyczne a pacjentami, którzy nie otrzymywali leków antyfibrotycznych, przy poziomie istotności p=0,001.22
Australijski rejestr IPF: znaczna poprawa* przeżywalności pacjentów z IPF leczonych lekami antyfibrotycznymi w porównaniu z pacjentami nieleczonymi23†
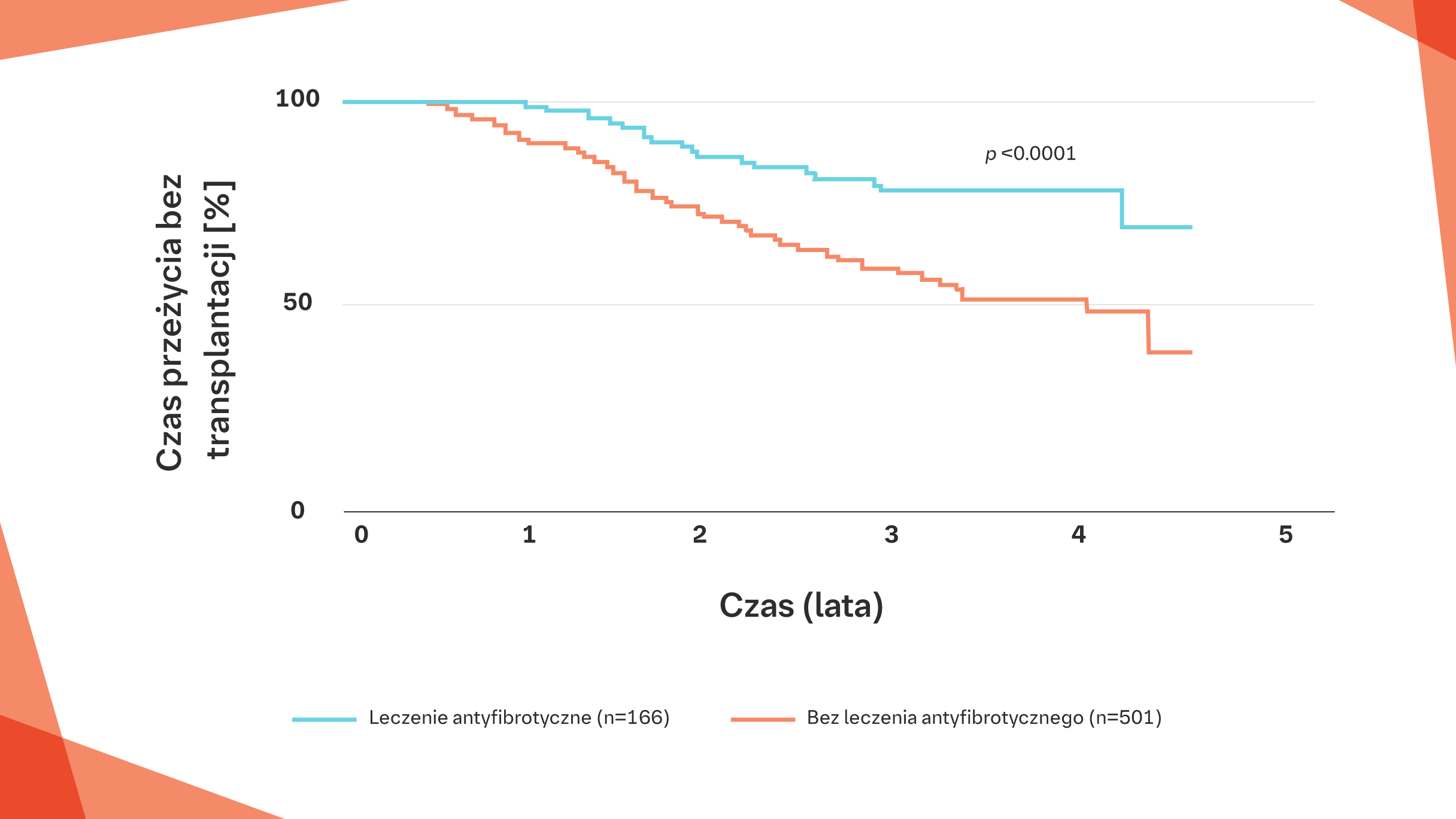
* HR 0,38, 95% CI: 0,24–0,59, p<0,001.
† Pacjenci, którym przeszczepiono płuco, zostali ocenzurowani w analizie. W celu obliczenia śmiertelności w skali roku przeprowadzono analizę metodą Kaplana‑Meiera oraz jednoczynnikową analizę Coxa.23
Fiński rejestr IPF: znaczna poprawa przeżywalności pacjentów z IPF leczonych lekami antyfibrotycznymi przez >6 miesięcy w porównaniu z pacjentami nieleczonymi24*†
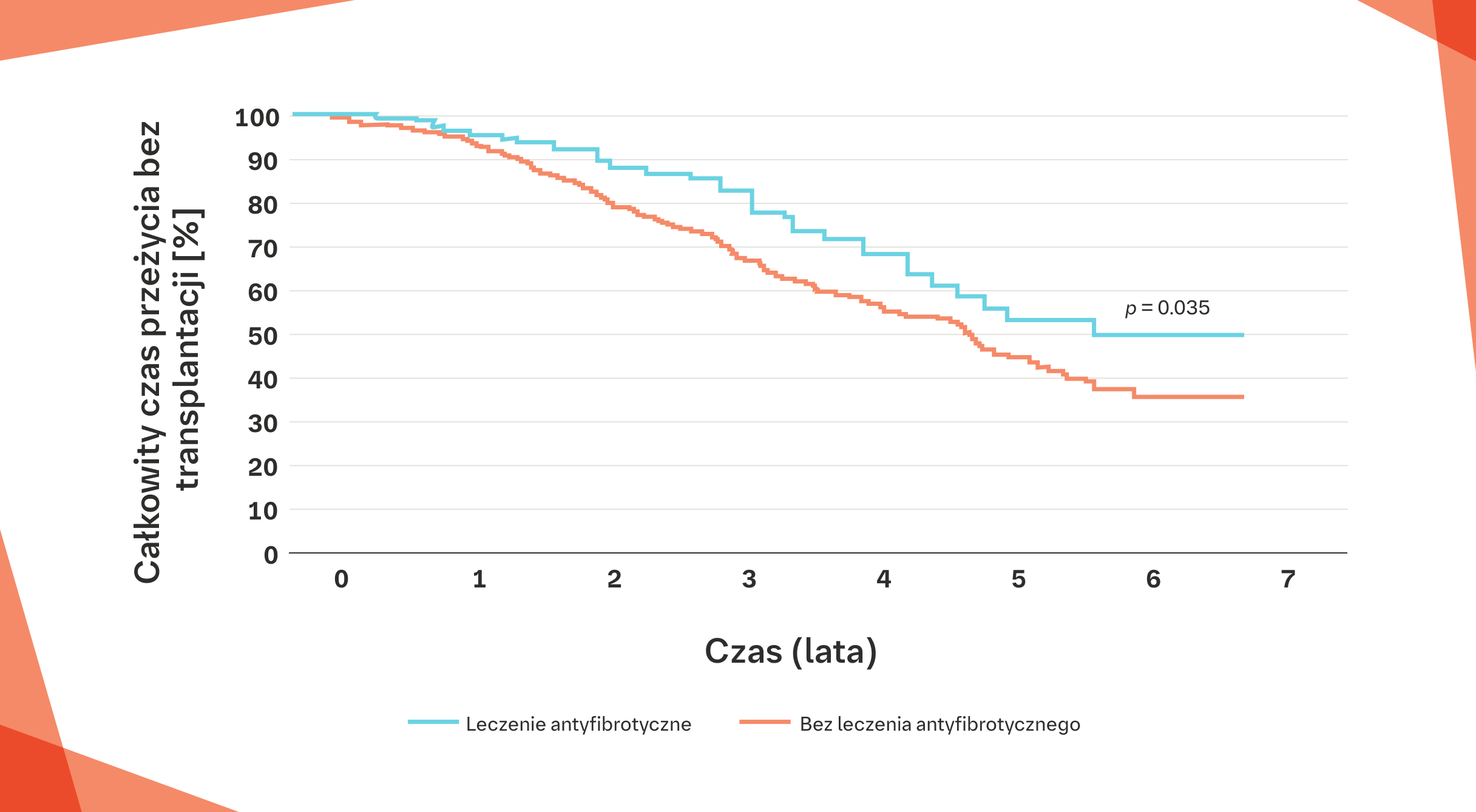
* Na podstawie fińskiego rejestru IPF (2011–2015) (n=453) koordynowanego przez Jaanę Kaunisto.
† Czas przeżycia bez transplantacji mierzono od momentu rozpoznania do wystąpienia zgonu lub do dnia transplantacji. Przeżycie oceniano za pomocą metody Kaplana‑Meiera, a różnice w krzywych przeżycia oceniano za pomocą testu log‑rank. Związek zmiennych z przeżyciem analizowano za pomocą jednoczynnikowej analizy regresji Coxa.
Rejestr INSIGHTS-IPF: znaczna poprawa* przeżywalności pacjentów z IPF leczonych lekami antyfibrotycznymi w porównaniu z pacjentami nieleczonymi25†
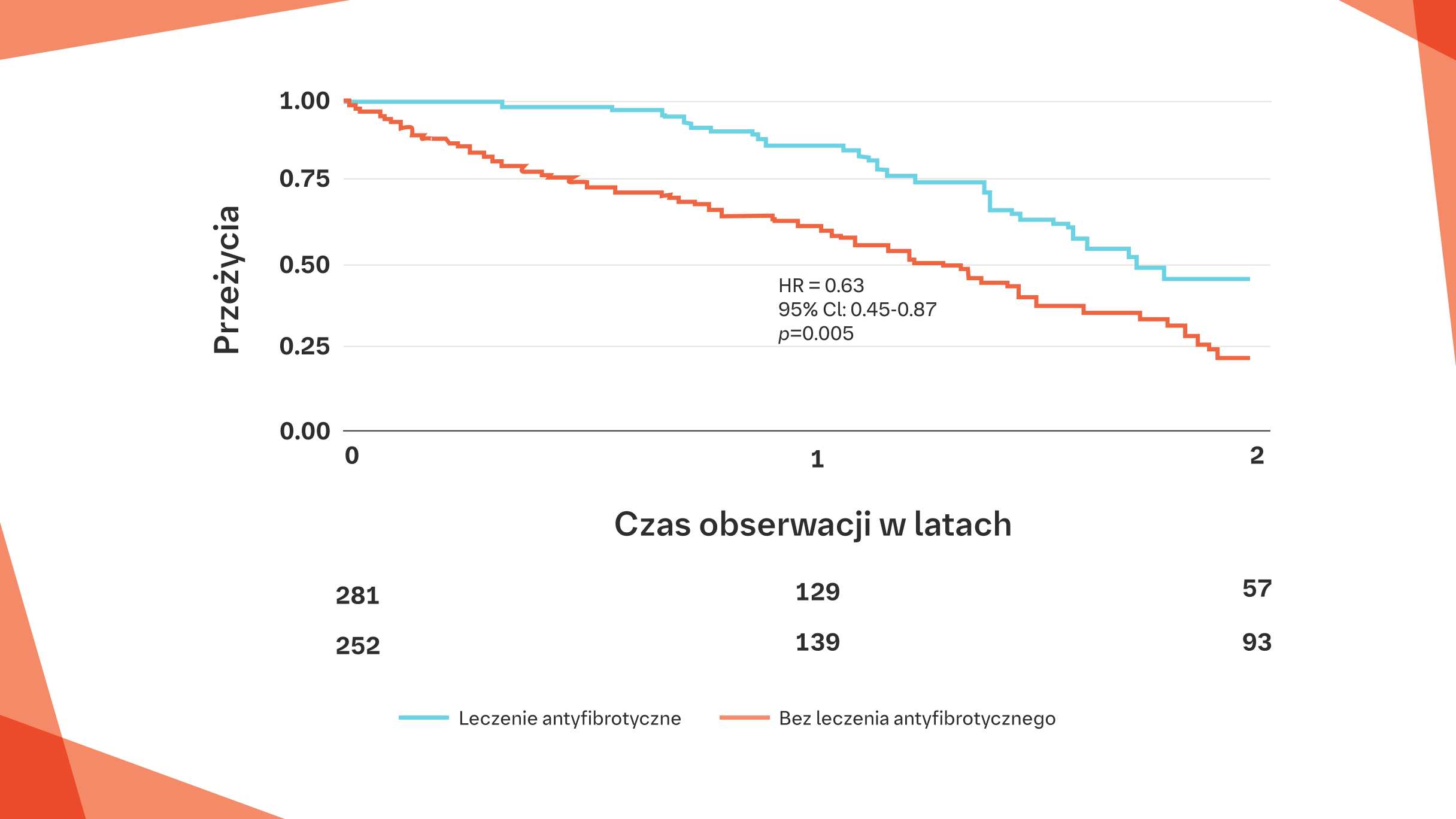
* HR: 0,63, 95% CI: 0,45–0,87, p=0,005
† Na podstawie rejestru INSIGHTS‑IPF przedstawionego przez prof. Jürgena Behra.
POSTĘPOWANIE W ILD TYPU INNEGO NIŻ IPF
Leczenie przewlekłej włókniejącej ILD typu innego niż IPF o fenotypie postępującym nie może czekać5,7,26,27
Zalecenia konsensusu dotyczące rozpoznawania i leczenia przewlekłej włókniejącej ILD typu innego niż IPF o fenotypie postępującym28
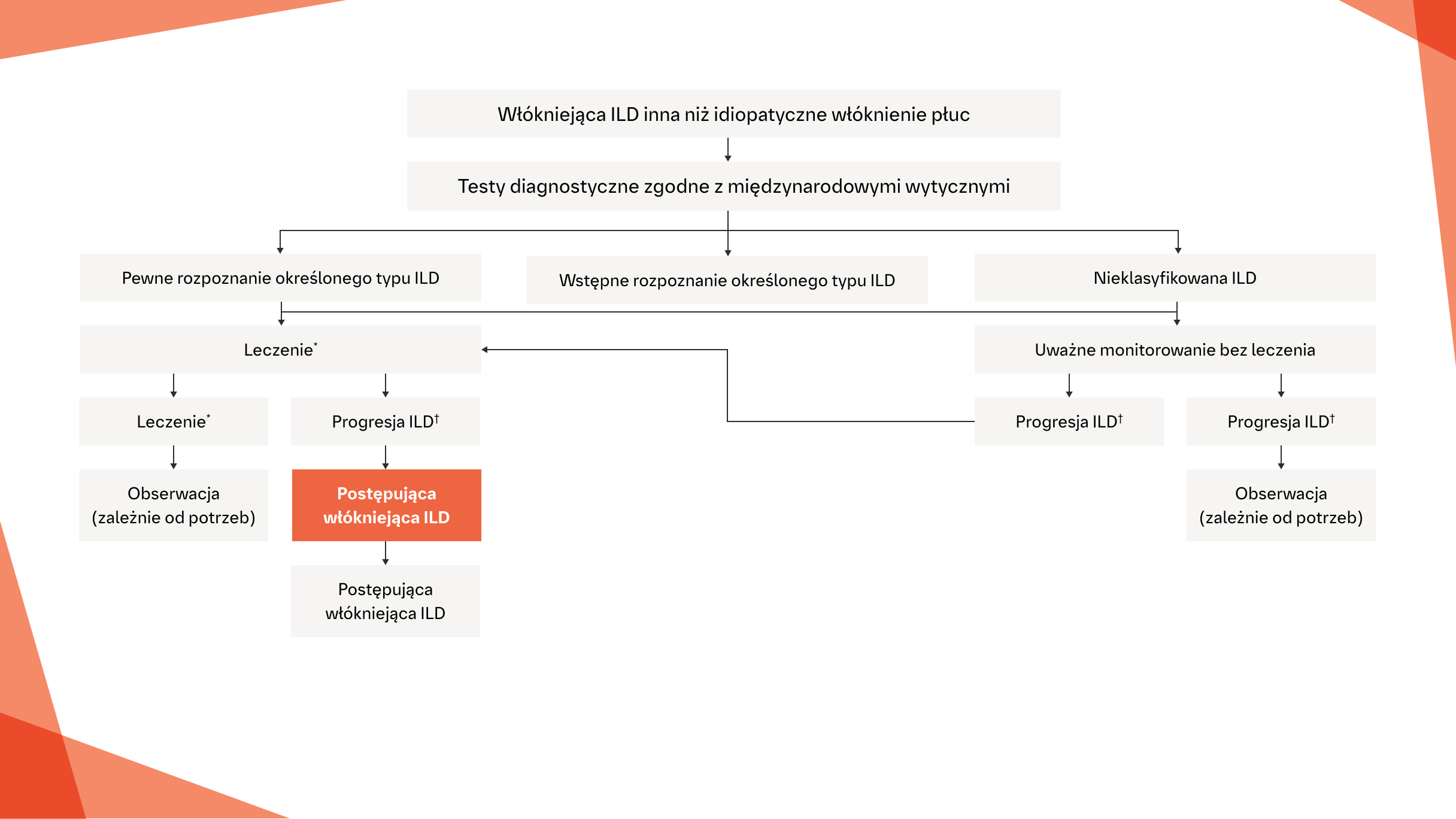
* Standardowe postępowanie dla określonego typu ILD.
† Definicja progresji ILD została opisana w publikacji: George PM i wsp. Lancet Respir Med. 2020;8:925-934.
‡ Zależnie od statusu rejestracji w poszczególnych krajach.
Na podstawie: George PM i wsp. Lancet Respir Med. 2020;8:925-954.
Potencjalne działania, które mogą pomóc w zapobieganiu nagłym zaostrzeniom ILD o fenotypie postępującego włóknienia:29
Szczepienie przeciwko grypie i pneumokokom
Mycie rąk i unikanie kontaktu z osobami chorymi
Unikanie substancji drażniących i zanieczyszczeń unoszących się w powietrzu
Strategie minimalizowania uszkodzenia płuc wywołanego wentylacją mechaniczną
W KONTEKŚCIE LECZENIA POSZCZEGÓLNYCH TYPÓW ILD OKREŚLONO ZALECENIA DOTYCZĄCE STOSOWANIA ZARÓWNO METOD FARMAKOLOGICZNYCH, JAK I NIEFARMAKOLOGICZNYCH
ZALECENIA DOTYCZĄCE POSTĘPOWANIA W ZAPALENIU PŁUC WYNIKAJĄCYM Z NADWRAŻLIWOŚCI:
Identyfikacja i wyeliminowanie antygenu odpowiedzialnego za reakcję nadwrażliwości powinny być zawsze pierwszym krokiem w leczeniu HP30
U pacjentów z HP ustalenie antygenu wywołującego jest ważne dla udzielenia pacjentowi odpowiedniej porady oraz ustalenia właściwego postępowania31
Leczenie farmakologiczne może być właściwe, ale ważne jest, aby ponownie ocenić odpowiedź na leczenie po 3 miesiącach, ponieważ pacjenci z HP, u których czynność płuc nie ustabilizuje się do tego czasu, są narażeni na zwiększone ryzyko zgonu28,30
Jeśli dana terapia farmakologiczna jest nieskuteczna po 3–6 miesiącach stosowania, należy rozważyć terapie alternatywne30
ZALECENIA DOTYCZĄCE POSTĘPOWANIA W SAMOISTNYM NIESWOISTYM ŚRÓDMIĄŻSZOWYM ZAPALENIU PŁUC (iNSIP):
Podobnie jak w przypadku pacjentów z HP, leczenie farmakologiczne może być właściwe, ale ważne jest, aby ponownie ocenić odpowiedź na leczenie po 3 miesiącach, ponieważ pacjenci z NSIP, u których czynność płuc nie ustabilizuje się do tego czasu, są narażeni na zwiększone ryzyko zgonu28
Opieka wspomagająca dla pacjentów z iNSIP obejmuje tlenoterapię i rehabilitację pulmonologiczną32
Transplantację płuc należy zalecać u pacjentów z postępującą iNSIP32
ZALECENIA DOTYCZĄCE POSTĘPOWANIA W ŚRÓDMIĄŻSZOWEJ CHOROBIE PŁUC ZWIĄZANEJ Z SARKOIDOZĄ:
Leczenie należy stosować u pacjentów spełniających następujące kryteria:33
Nasilające się objawy
Ograniczona aktywność
Wyraźnie nieprawidłowa lub pogarszająca się czynność płuc
Niekorzystne zmiany w obrazie RTG
KWESTIE DOTYCZĄCE POSTĘPOWANIA W NIEKLASYFIKOWANEJ CHOROBIE ŚRÓDMIĄŻSZOWEJ PŁUC (uILD):
Niefarmakologiczne metody leczenia włókniejącej ILD, które należy rutynowo brać pod uwagę:34
Zaprzestanie palenia tytoniu
Unikanie potencjalnie szkodliwych czynników
Szczepienia przeciwko pneumokokom i grypie
Rehabilitacja pulmonologiczna
Długotrwała tlenoterapia
Leczenie chorób współistniejących
KWESTIE DOTYCZĄCE POSTĘPOWANIA W ŚRÓDMIĄŻSZOWEJ CHOROBIE PŁUC W PRZEBIEGU TWARDZINY UKŁADOWEJ (SSc‑ILD):
Rozpoczęcie leczenia u pacjentów z SSc-ILD powinno mieć na celu zapobieganie progresji choroby, aby uniknąć nieodwracalnego uszkodzenia płuc4,35,36
Obecna praktyka leczenia pacjentów z SSc‑ILD po wystąpieniu pogorszenia jest nieoptymalna4
Może to prowadzić do przeoczenia możliwości leczenia pacjentów, u których choroba postępuje, ponieważ w trakcie dalszej obserwacji stan tych pacjentów może być stabilny
KWESTIE DOTYCZĄCE POSTĘPOWANIA W ŚRÓDMIĄŻSZOWEJ CHOROBIE PŁUC W PRZEBIEGU REUMATOIDALNEGO ZAPALENIA STAWÓW (RZS‑ILD):
Progresja i nasilenie ILD są głównymi czynnikami, które należy brać pod uwagę przy podejmowaniu decyzji terapeutycznych.37 Leczenie można rozważać:
Niezależnie od obrazu w badaniu HRCT (UIP lub NSIP)
Jeśli ILD jest istotna klinicznie (objawy, nasilenie)
Jeśli ILD ma charakter postępujący
Więcej informacji na temat możliwości postępowania w RZS‑ILD
Jakie inne kwestie należy brać pod uwagę w kontekście postępowania?
Zapewnienie opieki paliatywnej/wspomagającej

Zespoły wielodyscyplinarne
Przypisy
-
*
Rozpoczęcie leczenia zależy od dostępności terapii zatwierdzonych w danym kraju.
-
Maher TM, Molina-Molina M, Russell AM i wsp. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Robalo-Cordeiro C, Campos P, Carvalho L i wsp. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
-
Distler O, Volkmann ER, Hoffmann-Vold AM i wsp. Current and future perspectives on management of systemic sclerosis-associated interstitial lung disease. Expert Rev Clin Immunol. 2019;15:1009–1017.
-
Wijsenbeek MS, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
-
Flaherty KR i wsp. Design of the PF-ILD trial: a double-blind, randomised, placebo-controlled phase III trial of nintedanib in patients with progressive fibrosing interstitial lung disease. BMJ Open Respir Res. 2017;4(1):e000212.
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Ryerson C, Cottin V, Brown K, Collard H. Acute exacerbation of idiopathic pulmonary fibrosis: shifting the paradigm. Eur Respir J. 2015;46(2):512–520.
-
van Manen MJ, Geelhoed JJ, Tak NC, Wijsenbeek MS. Optimizing quality of life in patients with idiopathic pulmonary fibrosis. Ther Adv Respir Dis. 2017;11(3):157–169.
-
Hambly N, Cox G, Kolb M. Acute exacerbations of idiopathic pulmonary fibrosis: tough to define; tougher to manage. Eur Respir J. 2017;49(5):1700811.
-
Torrisi SE, Pavone M, Vancheri A, Vancheri C. When to start and when to stop antifibrotic therapies. Eur Respir Rev. 2017;26(145):170053.
-
Cosgrove GP, Bianchi P, Danese S, Lederer DJ. Barriers to timely diagnosis of interstitial lung disease in the real world: the INTENSITY survey. BMC Pulm Med. 2018;18(1):9.
-
Ley B, Collard HR, King TE Jr. Clinical course and prediction of survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2011;183(4):431–440.
-
Richeldi L, Crestani B, Azuma A i wsp. Outcomes following decline in forced vital capacity in patients with idiopathic pulmonary fibrosis: Results from the INPULSIS and INPULSIS-ON trials of nintedanib. Resp Med. 2019;156:20–25.
-
Maher TM, Stowasser S, Nishioka Y i wsp. Biomarkers of extracellular matrix turnover in patients with idiopathic pulmonary fibrosis given nintedanib (INMARK study): a randomised, placebo-controlled study. Lancet Respir Med. 2019;S2213-2600(19)30255-3.
-
Maher TM, Strek ME. Antifibrotic therapy for idiopathic pulmonary fibrosis: time to treat. Respir Res. 2019;20:205.
-
Kolb M, Richeldi L, Behr J i wsp. Nintedanib in patients with idiopathic pulmonary fibrosis and preserved lung volume. Thorax. 2017;72:340–346.
-
Poletti V, Vancheri C, Albera C. Clinical course of IPF in Italian patients during 12 months of observation: results from the FIBRONET observational study. Prezentacja posterowa podczas Międzynarodowego Kongresu Europejskiego Towarzystwa Chorób Układu Oddechowego, 28 września – 2 października 2019 r., Madryt, Hiszpania.
-
Moua T, Ryu JH. Obstacles to early treatment of idiopathic pulmonary fibrosis: current perspectives. Ther Clin Risk Manag. 2019;15:73–81.
-
Guenther A, Krauss E, Tello S i wsp. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respir Res. 2018;19(1):141.
-
Jo HE, Glaspole I, Grainge C i wsp. Baseline characteristics of idiopathic pulmonary fibrosis: analysis from the Australian Idiopathic Pulmonary Fibrosis Registry. Eur Respir J. 2017;49:1601592.
-
Kaunisto J, Salomaa E, Hodgson U. Demographics and survival of patients with idiopathic pulmonary fibrosis in the Finnish IPF registry. ERJ Open Res. 2019;5:00170–2018.
-
Behr J, Prasse A, Wirtz H i wsp. Survival and course of lung function in the presence or absence of antifibrotic treatment in patients with idiopathic pulmonary fibrosis: long-term results of the INSIGHTS-IPF registry. Eur Respir J. 2020; w druku (https://doi.org/10.1183/13993003.02279-2019).
-
Geerts S, Wuyts W, De Langhe E i wsp. Connective tissue disease associated interstitial pneumonia: a challenge for both rheumatologists and pulmonologists. Sarcoidosis Vasc Diffuse Lung Dis. 2017;34(4):326–335.
-
Wells AU, Denton CP. Interstitial lung disease in connective tissue disease— mechanisms and management. Nat Rev Rheumatol. 2014;10(12):728–739.
-
George PM, Spagnolo P, Kreuter M i wsp. Progressive fibrosing interstitial lung disease: clinical uncertainties, consensus recommendations, and research priorities. Lancet Respir Med. 2020;8:925–954.
-
Kolb M, Bondue B, Pesci A i wsp. Acute exacerbations of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):pii:180071.
-
Varone F, Iovene B, Sgalla G i wsp. Fibrotic Hypersensitivity Pneumonitis: Diagnosis and Management. Lung. 2020;https://doi.org/10.1007/s00408-020-00360-3.
-
Fernandez Perez ER, Swigris JJ, Forssen AV i wsp. Identifying an Inciting Antigen Is Associated With Improved Survival in Patients With Chronic Hypersensitivity Pneumonitis. Chest. 2013;144:1644–1651.
-
Tomassetti S i wsp. Semin Respir Crit Care Med. 2016;37:378–394.
-
Ianuzzi MC, Sah BP. Sarcoidosis. Merck Manual Professional Version website. Informacje dostępne pod adresem: https://www.merckmanuals.com/professional/pulmonary-disorders/sarcoidosis/sarcoidosis. Sierpień 2017. Dostęp: Listopad 2020.
-
Guler SA, Ryerson CJ. Unclassifiable interstitial lung disease: from phenotyping to possible treatments. Curr Opin Pulm Med. 2018;24:461–468.
-
Hoffmann-Vold AM, Allanore Y, Alves M i wsp. Progressive interstitial lung disease in patients with systemic sclerosis-associated interstitial lung disease in the EUSTAR database. Ann Rheum Dis. 2020a;217455.
-
Hoffmann-Vold AM, Maher TM, Philpot EE i wsp. The identification and management of interstitial lung disease in systemic sclerosis: evidence-based European consensus statements. The Lancet Rheumatology. 2020b;2:e71–e83.
-
Cassone G, Manfredi A, Vacchi C i wsp. Treatment of rheumatoid arthritis-associated interstitial lung disease: lights and shadows. J Clin Med. 2020;9(4):1082. doi: 10.3390/jcm9041082.
-
Lake F and Proudman S. Rheumatoid arthritis and lung disease: from mechanisms to a practical approach. Semin Respir Crit Care Med. 2014;35(2):222–238.
-
Ryerson CJ, Cayou C, Topp F i wsp. Pulmonary rehabilitation improves long-term outcomes in interstitial lung disease: a prospective cohort study. Respir Med. 2014;108(1):203–210.
-
Kreuter M, Bendstrup E, Russell A i wsp. Palliative care in interstitial lung disease: living well. Lancet Respir Med. 2017;5(12):968–980.
-
Maher TM, Wuyts W. Management of Fibrosing Interstitial Lung Diseases. Adv Ther. 2019;doi:10.1007/s12325-019-00992-9. [publikacja elektroniczna przed drukiem].
-
Sgalla G, Cerri S, Ferrari R i wsp. Mindfulness-based stress reduction in patients with interstitial lung diseases: a pilot, single-centre observational study on safety and efficacy. BMJ Open Respir Res. 2015;2(1):e000065.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
Materiały dla pacjentów po angielsku





