Rozpoznanie ILD
Diagnostyka różnicowa ILD może być trudna ze względu na nakładanie się obrazu klinicznego, radiologicznego i patologicznego1,2

W CELU WCZESNEGO I DOKŁADNEGO ROZPOZNANIA ILD ZALECA SIĘ PODEJŚCIE WIELODYSCYPLINARNE OBEJMUJĄCE PRZEGLĄD KLINICZNY, RADIOLOGICZNY I PATOLOGICZNY1,3–6
Przykład zespołu wielodyscyplinarnego
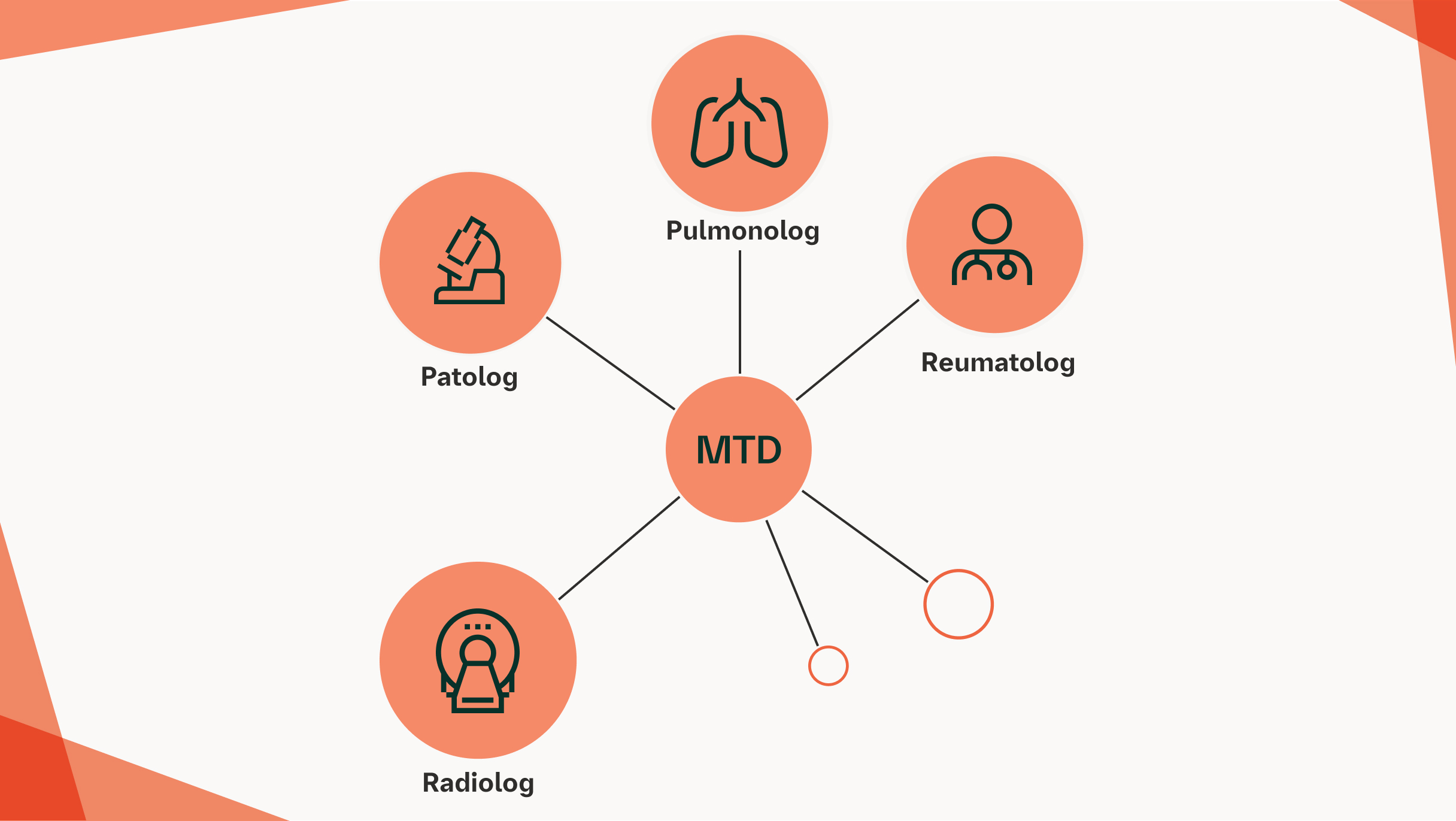
Zaleca się, aby wszystkie zebrane informacje diagnostyczne były oceniane przez wielodyscyplinarny zespół mający doświadczenie w ILD, który może ustalić rozpoznanie bądź omówić wskazania do dalszych procedur diagnostycznych, takich jak torakoskopowa biopsja płuca lub kriobiopsja przezoskrzelowa.7
Ważnym elementem dyskusji pomiędzy członkami zespołu wielodyscyplinarnego a pacjentem jest zestawienie korzyści diagnostycznych z potencjalnym ryzykiem związanym z każdą procedurą.7
Algorytm diagnostyczny we włóknieniu płuc7
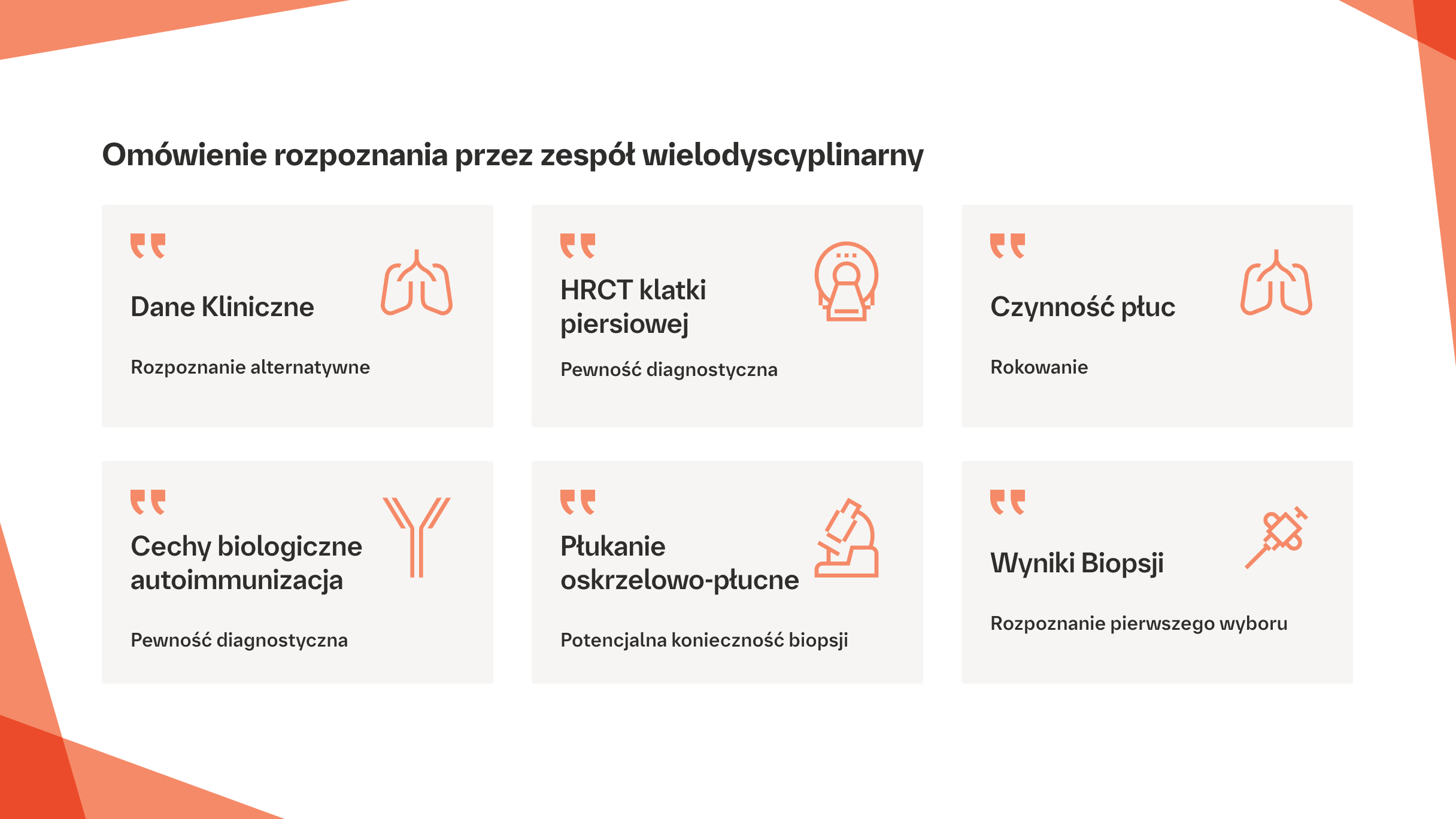
Uczestnicy biorą pod uwagę wszystkie dostępne dane i proponują wstępne rozpoznanie pierwszego wyboru, oceniają potrzebę wykonania biopsji i wiarygodność rozpoznania, a także rozważają możliwe rozpoznania alternatywne. Jeśli dany przypadek nie może zostać rozpatrzony przez zespół wielodyscyplinarny, ważne jest, aby lekarz prowadzący leczenie zdawał sobie sprawę z tego, że przed podjęciem decyzji diagnostycznych należy rozważyć wiele czynników.
Na podstawie: Wijsenbeek M, Cottin V. N Engl J Med. 2020;383:958–968.
Inne kwestie istotne w kontekście rozpoznania ILD:
- Przy osłuchiwaniu klatki piersiowej drobne trzeszczenia typu „taśmy rzepowej” wskazują na włóknienie7
- Należy przeprowadzić dokładny wywiad z pacjentem, obejmujący czynniki narażenia środowiskowego, stosowanie leków i objawy pozapłucne7
Inne kwestie dotyczące rozpoznania ILD w przebiegu CTD:
- W przebiegu CTD ILD może rozwinąć się zarówno po rozpoznaniu CTD, jak i przed wystąpieniem objawów reumatologicznych tej choroby
- Dlatego tak ważne jest przeprowadzenie badań przedmiotowych i serologicznych w przypadku jakiegokolwiek podejrzenia CTD‑ILD7
Co jeszcze należy wziąć pod uwagę przy rozpoznawaniu CTD‑ILD?
Co należy zrobić, jeśli po przeprowadzeniu oceny nie można sklasyfikować przyczyny ILD?
- Niektóre przypadki ILD pozostają niesklasyfikowane nawet po dokładnej ocenie.7 W przypadku pojawienia się nowych informacji rozpoznanie robocze może później stać się bardziej definitywnym rozpoznaniem różnicowym
ROZPOZNANIE IPF
W celu wczesnego i dokładnego rozpoznania IPF wytyczne zalecają podejście wielodyscyplinarne obejmujące przegląd kliniczny, radiologiczny i patologiczny:3,9–11


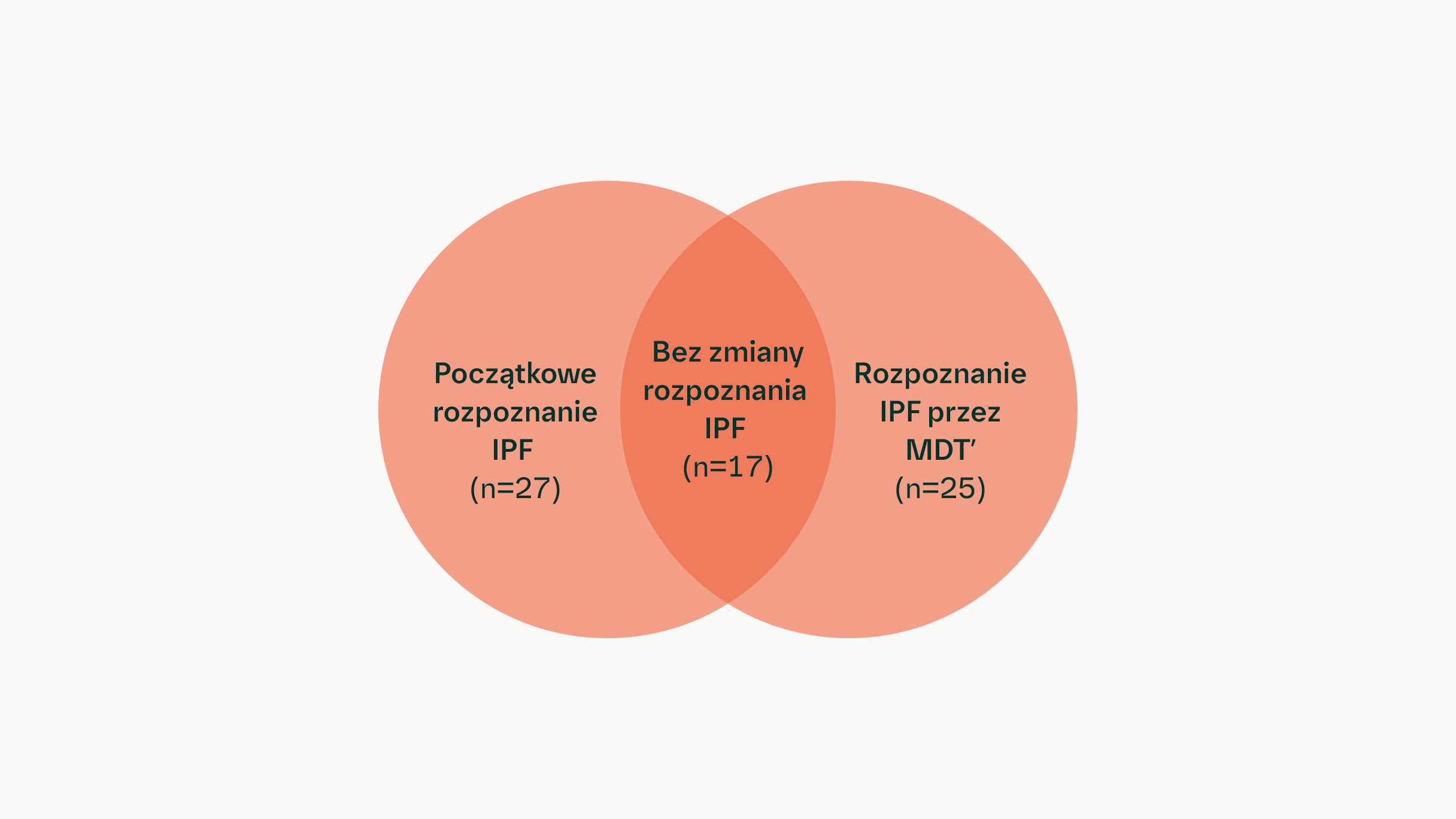
W badaniu australijskim (n=90) dyskusja wielodyscyplinarna prowadziła do zmiany rozpoznania: u 10 (37%) z 27 pacjentów skierowanych z rozpoznaniem IPF zmieniono diagnozę na inną niż IPF, a u 7 pacjentów zmieniono diagnozę na IPF w wyniku dyskusji MDT13
Algorytm diagnostyczny umożliwiający dokładne i szybkie rozpoznanie IPF na podstawie wytycznych ATS/ERS/JRS/ALAT3
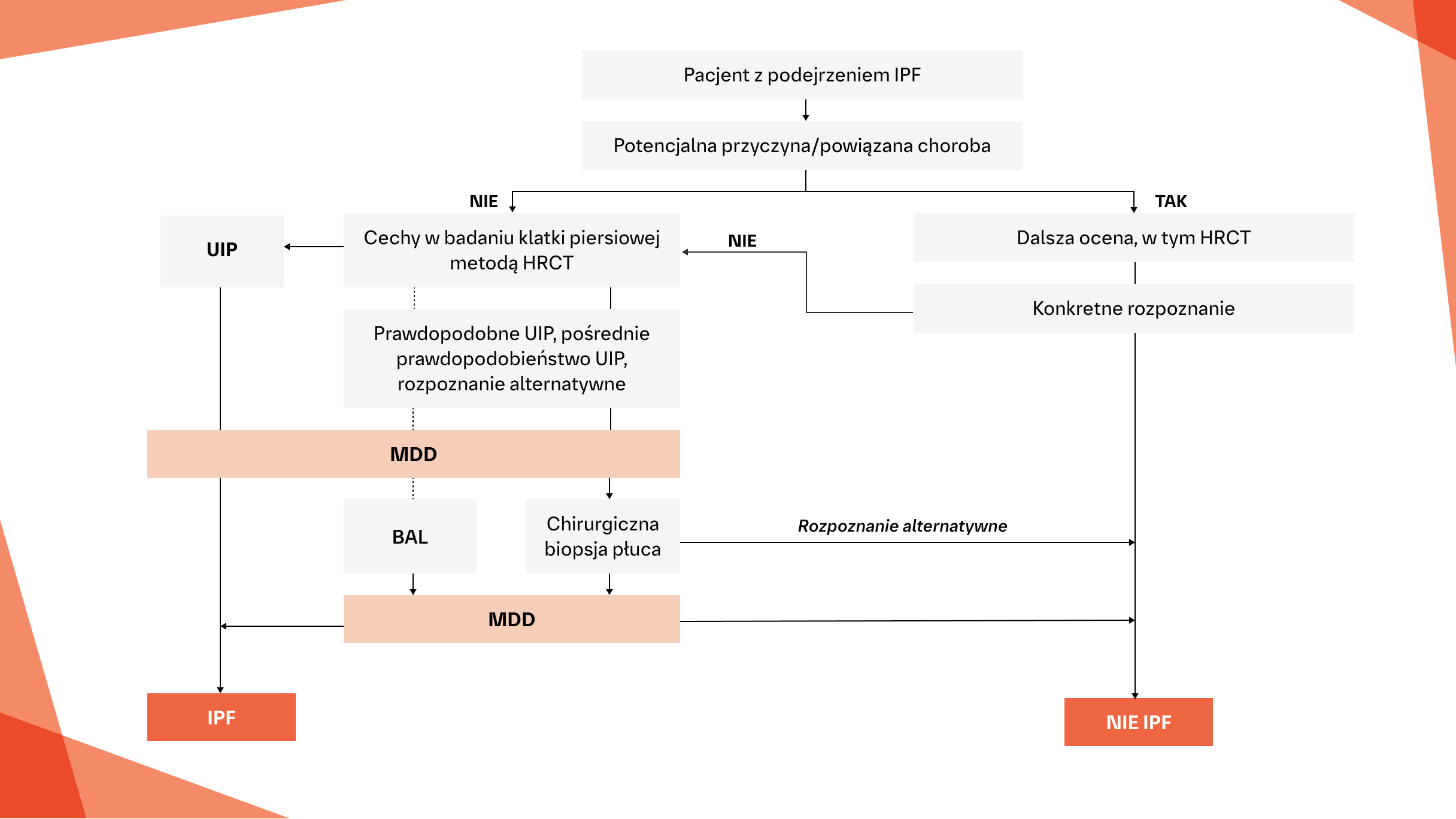
* Chirurgiczna biopsja płuca nie jest wskazana u pacjentów z wysokim ryzykiem powikłań śród-, około- lub pooperacyjnych (np. ciężka hipoksemia w spoczynku i/lub ciężkie nadciśnienie płucne z pojemnością dyfuzyjną poniżej 25% po korekcie uwzględniającej wartość hematokrytu). Chirurgiczna biopsja płuc może nie być konieczna w niektórych przypadkach rodzinnych.3
U pacjentów z ryzykiem wystąpienia IPF należy wykonać badanie HRCT przy pierwszym podejrzeniu ILD.9
Cechy odpowiadające obrazowi UIP w badaniu HRCT:9
Obraz plastra miodu
Zmiany siateczkowe
Trakcyjne rozstrzenie oskrzeli
Wytyczne ATS/ERS/JRS/ALAT zalecają pewne rozpoznanie IPF, jeśli ocena kliniczna pacjenta wskazuje na IPF, a badanie HRCT wykazuje definitywny lub prawdopodobny obraz UIP (zalecana biopsja warunkowa).3
Rozpoznanie IPF na podstawie badania HRCT i obrazów w badaniu wycinka biopsyjnego zgodnie z wytycznymi ATS/ERS/JRS/ALAT w kwestii praktyki klinicznej 20183
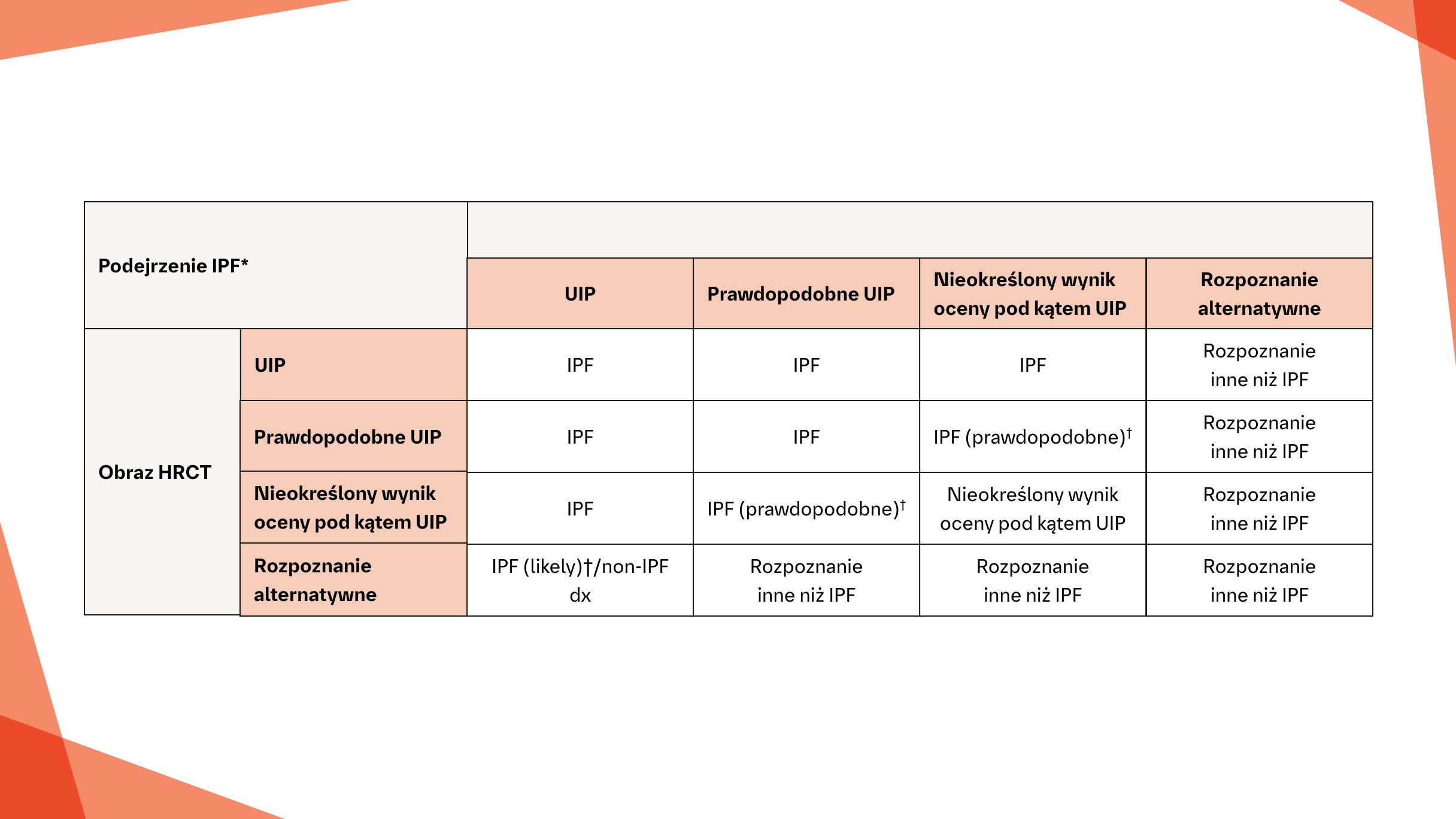
Jeżeli nie zostanie ustalone konkretne rozpoznanie lub nie zostanie zidentyfikowana potencjalna przyczyna ILD, wówczas w rozważaniach zespołu wielodyscyplinarnego należy rozważyć wyniki oceny klinicznej oraz odpowiednią kombinację wyników badania HRCT i obrazu histopatologicznego, aby potwierdzić lub wykluczyć rozpoznanie IPF.3
-
*
Pacjenci z klinicznym podejrzeniem IPF to osoby z niewyjaśnionymi objawowymi lub bezobjawowymi oznakami obustronnego włóknienia płuc w badaniu radiologicznym klatki piersiowej lub w tomografii komputerowej klatki piersiowej, trzeszczeniami wdechowymi u podstawy płuc oraz w wieku powyżej 60 lat. 3
-
†
IPF jest prawdopodobnym rozpoznaniem, gdy występuje którakolwiek z poniższych cech: 3
-
•
Umiarkowane do ciężkich trakcyjne rozstrzenia oskrzeli/rozstrzenie oskrzelików (zdefiniowane jako łagodne trakcyjne rozstrzenia oskrzeli/ rozstrzenia oskrzelików w co najmniej czterech płatach, w tym w języczku płuca traktowanym jako płat, lub umiarkowane do ciężkich trakcyjne rozstrzenia oskrzeli w co najmniej dwóch płatach) u mężczyzny w wieku powyżej 50 lat lub u kobiety w wieku powyżej 60 lat
-
•
Rozległe (>30%) zmiany siateczkowe w badaniu HRCT i wiek >70 lat
-
•
Zwiększona liczba neutrofilów i/lub niewystępowanie limfocytozy w płynie z BAL • Dyskusja wielodyscyplinarna prowadzi do pewnego rozpoznania IPF
-
‡
Nieokreślony wynik oceny pod kątem IPF:3
-
•
Bez odpowiedniej biopsji rozpoznanie IPF jest mało prawdopodobne
-
•
Z odpowiednią biopsją rozpoznanie można uściślić po dyskusji w zespole wielodyscyplinarnym i/lub dodatkowej konsultacji
ROZPOZNANIE SAMOISTNEGO NIESWOISTEGO ŚRÓDMIĄŻSZOWEGO ZAPALENIA PŁUC (iNSIP)
Badania diagnostyczne w kierunku iNSIP obejmują:

(wykazujące restrykcyjne zaburzenia oddechowe)14

(zmiany typu „matowego szkła”; zmiany siateczkowe głównie w dolnej części płuc; mikroguzki; konsolidacja; minimalne zmiany typu „plastra miodu”)16

(wykazującą jednorodność zajęcia tkanki śródmiąższowej), wykonywaną, gdy badanie HRCT sugeruje obraz NSIP, który pokrywa się z cechami OP oraz DIP15,17

(płukanie oskrzelowo‑płucne)
W przypadkach gdy cechy kliniczne, radiologiczne i patologiczne nie pozwalają na jednoznaczne lub prawdopodobne rozpoznanie NSIP, zaleca się przeprowadzenie wielodyscyplinarnej dyskusji z udziałem pulmonologów, radiologów i patologów15
ROZPOZNANIE ŚRÓDMIĄŻSZOWEJ CHOROBY PŁUC ZWIĄZANEJ Z SARKOIDOZĄ
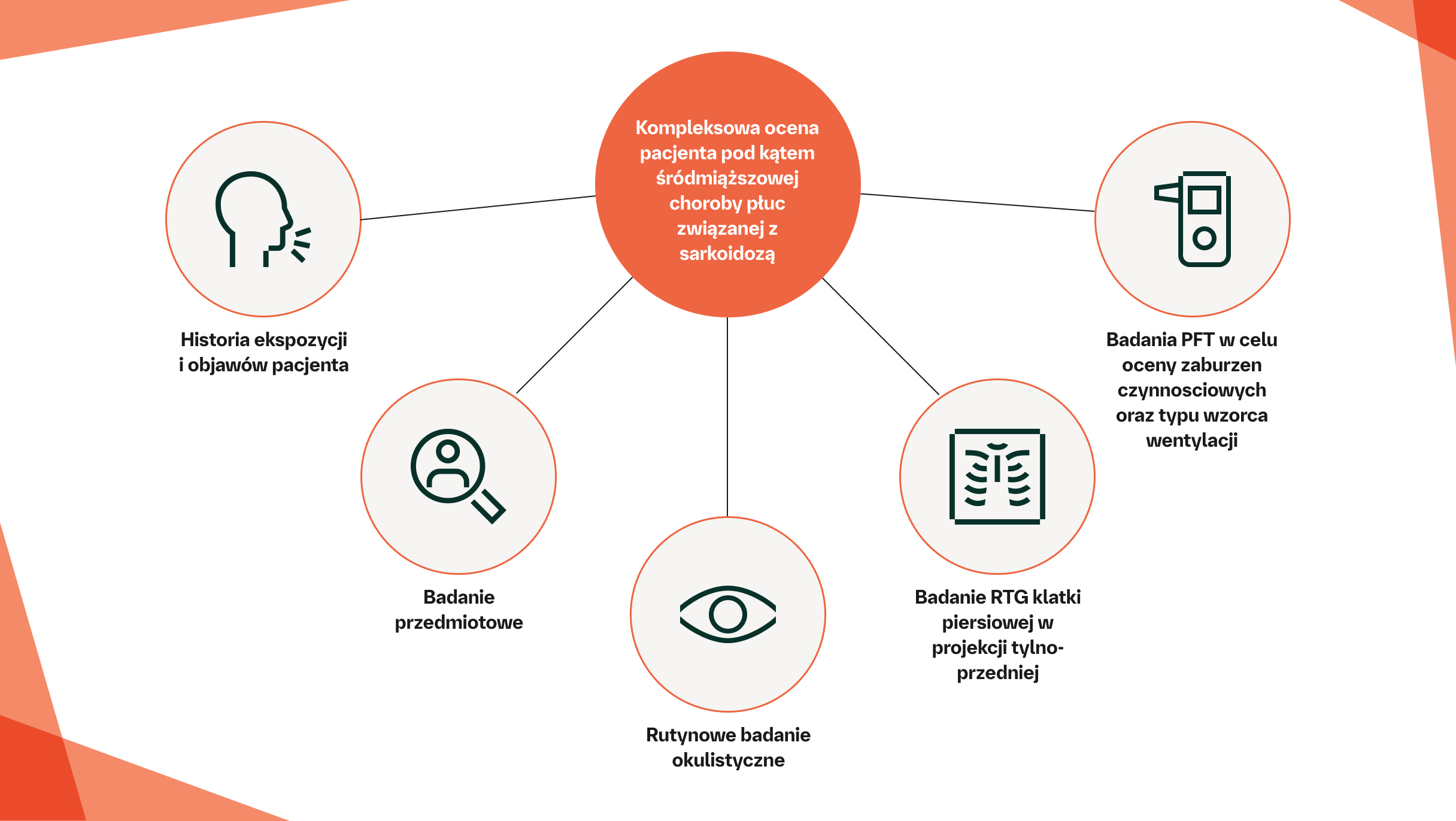
Wytyczne zalecają, aby rozpoznanie sarkoidozy obejmowało następujące narzędzia diagnostyczne:18




Kompleksowa ocena pacjenta pod kątem śródmiąższowej choroby płuc związanej z sarkoidozą powinna obejmować następujące procedury:18
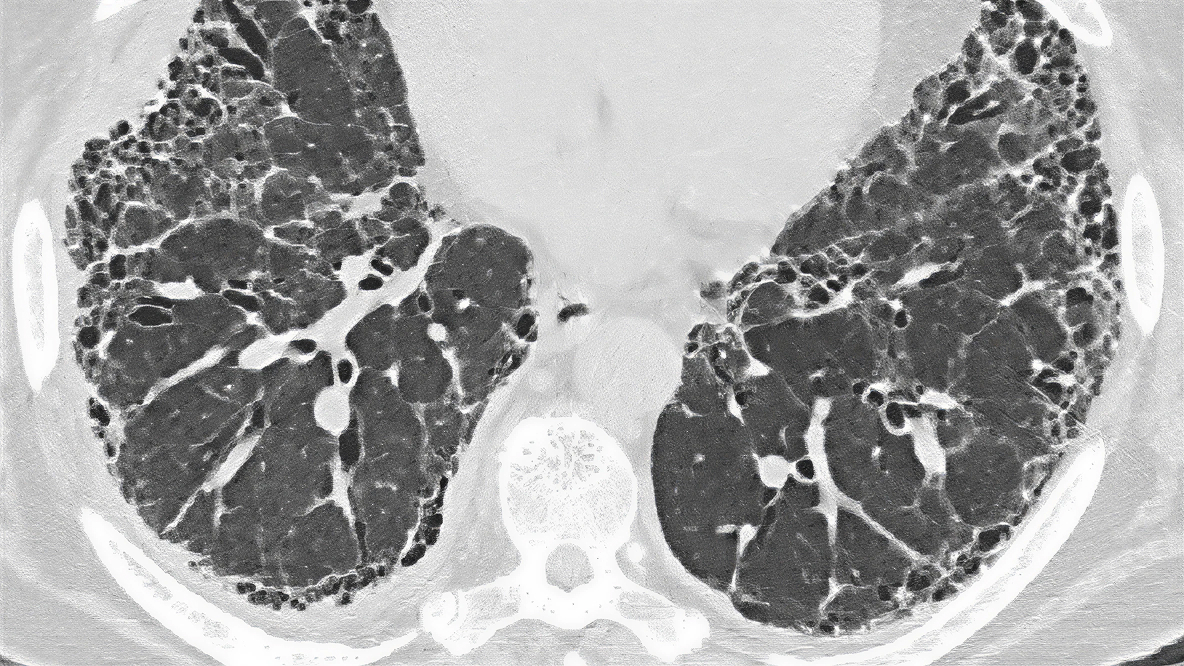
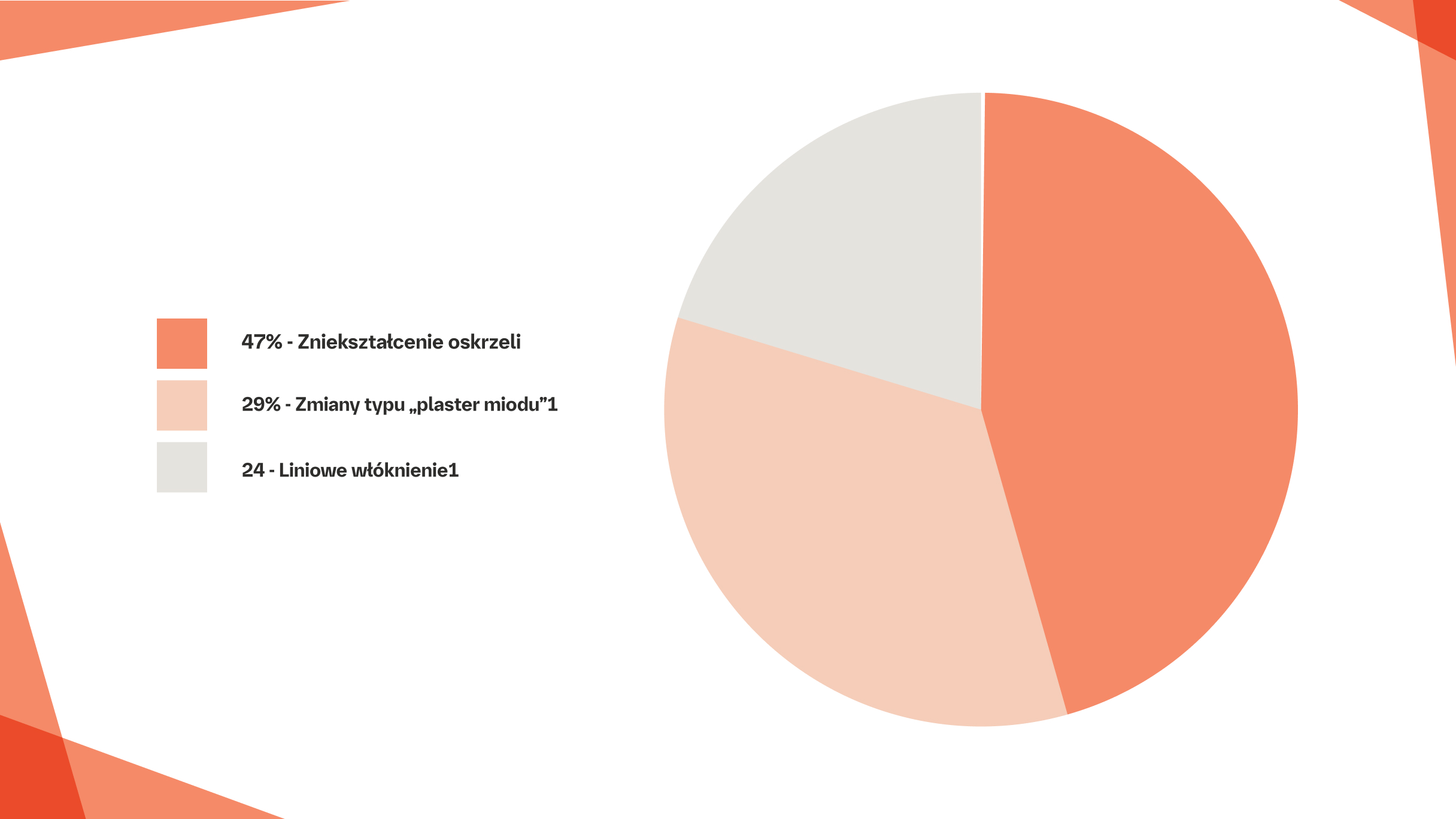
Badania TK u pacjentów z chorobą śródmiąższową płuc związaną z sarkoidozą pozwalają określić rozległość oraz typ zwłóknienia, które różnią się u poszczególnych pacjentów, ale zazwyczaj mają postać zniekształcenia oskrzeli (charakteryzującego się trakcyjnymi rozstrzeniami oskrzeli i kątowym przebiegiem dróg oddechowych), liniowego bliznowacenia i zmian typu „plastra miodu”.19
Odsetek pacjentów ze śródmiąższową chorobą płuc związaną z sarkoidozą z cechami radiologicznymi w badaniu HRCT (n=80)19
Jeśli połączenie wyników badań klinicznych i obrazowych nie pozwala na jednoznaczne określenie rozpoznania, w przypadku śródmiąższowej choroby płuc związanej z sarkoidozą może być konieczne wykonanie bardziej inwazyjnych procedur diagnostycznych, takich jak BAL.7
DIAGNOSTYKA ZAPALENIA PŁUC WYNIKAJĄCEGO Z NADWRAŻLIWOŚCI (HP)
Przede wszystkim należy dokładnie przeanalizować historię narażenia pacjenta.20
Jakie czynniki ryzyka HP związane z ekspozycją można zidentyfikować?
U pacjentów z włókniejącym HP w badaniu HRCT zazwyczaj występują zmiany siateczkowe, trakcyjne rozstrzenia oskrzeli i utrata objętości; mogą także występować zmiany typu „plastra miodu”:20
W podostrym HP typowy obraz HRCT to zmiany typu „matowego szkła”, a także nieostro odgraniczone guzki środkowej części zrazika20
Wydechowy obraz HRCT może być przydatny w diagnozowaniu cHP7
Podczas osłuchiwania klatki piersiowej u pacjentów z HP mogą być słyszalne piski świadczące o zwłóknieniu7
Biopsja chirurgiczna płuca może być konieczna w przypadkach, w których nie można zidentyfikować czynników narażenia lub w przypadku obrazu HRCT takiego jak UIP, który w mniejszym stopniu sugeruje HP21
Jeśli połączenie wyników badań klinicznych i obrazowych nie pozwala na jednoznaczne określenie rozpoznania, w przypadku HP może być konieczne wykonanie bardziej inwazyjnych procedur diagnostycznych, takich jak BAL7
Jak przekazać wiadomość pacjentom z włókniejącą ILD po postawieniu diagnozy?
Przekazywanie złych wiadomości to trudne i złożone zadanie komunikacyjne. W naszej serii filmów dokumentalnych profesor Walter Baile, psychiatra i współtwórca modelu SPIKES, przedstawia swoje praktyczne podejście do strukturyzacji trudnych rozmów
PRZEKAZYWANIE ZŁYCH WIADOMOŚCI
Część 1 – Wyzwanie związane z przekazywaniem złych wiadomości
Profesor Walter Baile przedstawia wyzwania związane z przekazywaniem złych wiadomości oraz czego możemy się nauczyć z doświadczeń w dziedzinie onkologii.
Johanna: [00:00:21 – 00:00:41] Breaking bad news about a terminal illness to a patient who’s not expecting it can be emotionally challenging for everyone involved. I know this because it happened to my grandmother who suffered from pulmonary fibrosis. So, I’m in Houston now to speak to Professor Walter Baile, who’s going to tell us more about communication and how to better the conversation.
BIG CONVERSATIONS An introduction to Professor Walter Baile and The SPIKES Model
Johanna: [00:39:34 – 00:39:37] So, Professor Baile, can you please introduce yourself?
Professor Baile: [00:39:37 - 00:39:59] So I’m Walter Baile and I’m a psychiatrist. And I did my psychiatry training at the Johns Hopkins Hospital in Baltimore, Maryland. And for the past 30 years, I’ve worked at M.D. Anderson Cancer Centre and organized a communication skills program called iCare, which is the program for interpersonal communication and relationship enhancement.
Johanna: [00:00:34 – 00:00:40] When you first started working in this field, how were bad news being communicated in oncology?
Professor Baile: [00:16:03 – 00:16:51] So, the fact is, is that bad news was rarely given to cancer patients and the diagnosis was often disguised behind words such as inflammation or mass. And clinicians at that time had very few treatments for cancer and patients feared it very much because often patients died in pain. And there was very little support for them. So, not giving a diagnosis of cancer or not telling the truth to patients was considered to be something ethical that doctors would do because they would spare the patient the suffering of knowing. So, almost uniformly, patients weren’t told.
Johanna: [00:16:52 – 00:17:00] But things have changed, and new treatments have become available. So, what are some of the new challenges that physicians are facing nowadays?
Professor Baile: [00:01:53 – 00:02:30] So as a colleague of mine once said, you know, the question is not whether to give bad news, but how to give it. And it’s still it’s a very big challenge for doctors, because many of them now really don’t have sufficient training to give bad news and because of that, they find it very challenging and stressful to deal with the emotions that often arise when patients are given adverse information about their medical condition, even though patients today want to be informed.
Johanna: [00:03:31 – 00:03:36] And you came out with a method for it. Can you briefly describe it?
Professor Baile: [00:03:39 – 00:03:59] We came up with a method which we call SPIKES, which is an organized stepwise program or a method for teaching communication skills and specifically giving bad news, which consists of six separate steps, which I can talk about in a little while.
Professor Baile: [00:04:34 – 00:04:59] It makes a lot of sense to doctors because they often learn to provide treatment and to diagnose disease based upon protocols and to follow guidelines for giving bad news. So that I think it’s become widely accepted because it has an inherent intuitive sense to doctors in other conditions who are giving bad news.
Johanna: [00:08:31 – 00:08:33] So, Professor Baile, what does SPIKES stand for?
Professor Baile: [00:08:34 – 00:09:22] So the S of SPIKES is for setting or setting up the interview, how you organise yourself before you go into the conversation. P is for perception. Finding out how much the patient already knows about the disease or the tests or any other information you want to know ‘I’ is for invitation and that is making sure the patient’s ready for the information. K is for knowledge and that is how to give the information in a way that the patient understands and allow them to share decisions. E is for emotions how to be empathic when the patient gets upset and ’S’ is for strategy and summary. How you sum up the conversation and help the patient understand what the treatment program is.
Johanna: [00:08:55 – 00:09:01] What is the objective of SPIKES with not just clinicians but also with patients?
Professor Baile: [00:09:05 – 09:13 and 00:09:27 – 09:52] Patients who receive bad news want to hear it in a compassionate way. So, what SPIKES does is addresses the most common emotional reactions with patients and whether it’s sadness or whether it’s fear or anxiety or crying spells and helps the clinician address that. It also prompts the doctor to prepare for giving bad news by kind of rehearsing in their own mind what they’re going to say and what they’re going to tell the patient.
Jak należy postępować z pacjentem z włókniejącą ILD po ustaleniu rozpoznania?

Czynniki ryzyka progresji

Wczesne i regularne monitorowanie
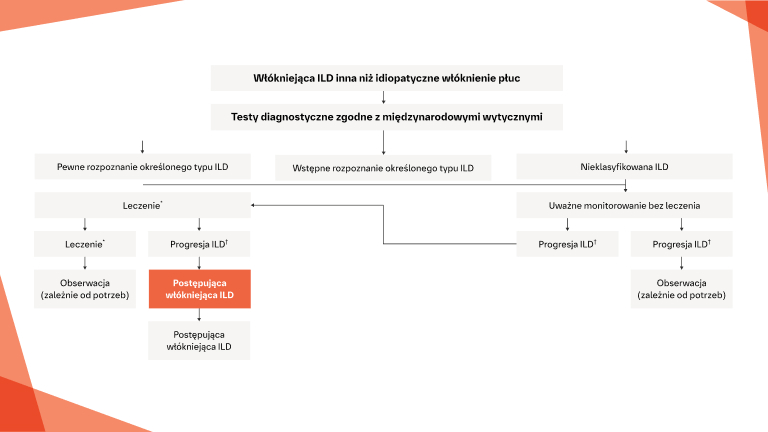
Interwencje w ILD
-
Cottin V, Hirani N, Hotchkin D i wsp. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180076.
-
Wong AW, Ryerson C, Guler S. Progression of fibrosing interstitial lung disease. Respir Res. 2020:29;21(1):32.
-
Raghu G, Remy-Jardin M, Myers JL, et al; w imieniu ATS/ERS/JRS/ALAT. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;198(5):e44–e68.
-
De Sadeleer LJ, Meert C, Yserbyt J i wsp. Diagnostic ability of a dynamic multidisciplinary discussion in interstitial lung diseases: A retrospective observational study of 938 cases. Chest. 2018;153(6):1416–1423.
-
Antoniou KM, Margaritopoulos GA, Tomassetti S, Bonella F, Costabel U, Poletti V. Interstitial lung disease. Eur Respir Rev. 2014;23(131):40–54.
-
Holtze C, Flaherty K, Kreuter M i wsp. Healthcare utilisation and costs in the diagnosis and treatment of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018;27(150):180078.
-
Wijsenbeek M, Cottin V. Spectrum of Fibrotic Lung Diseases. N Engl J Med. 2020;383:958–968.
-
Chowaniec M, Skoczynska M, Sokolik R, Wiland P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 2018;56(4):249–254.
-
Raghu G, Collard HR, Egan JJ i wsp.; w imieniu Komitetu ATS/ERS/JRS/ALAT ds. Idiopatycznego Włóknienia Płuc. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788–824.
-
Martinez FJ, Chisholm A, Collard HR i wsp. The diagnosis of idiopathic pulmonary fibrosis: current and future approaches. Lancet Respir Med. 2017;5(1):61–71.
-
Molina-Molina M, Aburto M, Acosta O i wsp. Importance of early diagnosis and treatment in idiopathic pulmonary fibrosis. Exp Rev Resp Med. 2018;12(7):537–539.
-
Walsh SLF, Wells AU, Desai SR i wsp. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diff use parenchymal lung disease: a case-cohort study. Lancet Respir Med. 2016;4:557–565.
-
Jo HE, Glaspole IN, Levin KC i wsp. Clinical impact of the interstitial lung disease multidisciplinary service. Respirology. 2016;21(8):1438–1444.
-
Tomassetti S, Ryu JH, Piciucchi i wsp. Nonspecific Interstitial Pneumonia: What Is the Optimal Approach to Management? Semin Respir Crit Care Med. 2016;37:378–394.
-
Travis WD, Hunninghake G, King Jr TE i wsp. Idiopathic nonspecific interstitial pneumonia: report of an American Thoracic Society project. Am J Respir Care Med. 2008;177:1338–1347.
-
Mueller-Mang C, Grosse C, Schmid K i wsp. What Every Radiologist Should Know about Idiopathic Interstitial Pneumonias. Radiographics. 2007;27:595–615.
-
Lynch DA, Travis WD, Muller NL. Idiopathic interstitial pneumonias: CT features. Radiology. 2005;236:10–21.
-
American Thoracic Society. Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, luty 1999. Am J Respir Med. 1999;160:736–755.
-
Abehsera M. Sarcoidosis with pulmonary fibrosis: CT patterns and correlation with pulmonary function. AJR Am J Roentgenol. 2000;174:1751–1757.
-
Kouranos V, Jacob J, Nicholson A i wsp. Fibrotic Hypersensitivity Pneumonitis: Key Issues in Diagnosis and Management. J Clin Med. 2017;6:62.
-
Morisset J, Johannson KA, Jones KD i wsp. Identification of Diagnostic Criteria for Chronic Hypersensitivity Pneumonitis. An International Modified Delphi Survey. Am J Resp Crit Care Med. 2018;197:1036–1044.
-
Wijsenbeek MS, Kreuter M, Olson A i wsp. Progressive fibrosing interstitial lung diseases: current practice in diagnosis and management. Curr Med Res Opin. 2019:1–10.
-
Kolb M, Vasakova M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res. 2019;20(1).
-
Cottin V, Wollin L, Fischer A i wsp. Fibrosing interstitial lung diseases: knowns and unknowns. Eur Respir Rev. 2019b;28(151):pii:180100.
-
Maher TM, Molina-Molina M, Russell AM i wsp. Unmet needs in the treatment of idiopathic pulmonary fibrosis-insights from patient chart review in five European countries. BMC Pulm Med. 2017;17(1):124.
-
Robalo-Cordeiro C, Campos P, Carvalho L i wsp. Idiopathic pulmonary fibrosis in the era of antifibrotic therapy: Searching for new opportunities grounded in evidence. Rev Port Pneumol. 2017;23(5):287–293.
Materiały dla pacjentów po angielsku




